12.2: Razões molares
Razões molares
Os problemas de estequiometria podem ser caracterizados por duas coisas: (1) a informação dada no problema, e (2) a informação a ser resolvida, chamada de desconhecido. O dado e o desconhecido podem ser reagentes, ambos produtos, ou um pode ser um reagente enquanto o outro é um produto. As quantidades das substâncias podem ser expressas em moles. No entanto, em uma situação de laboratório, é comum determinar a quantidade de uma substância encontrando sua massa em gramas. A quantidade de uma substância gasosa pode ser expressa pelo seu volume. Neste conceito, vamos nos concentrar no tipo de problema em que as quantidades fornecidas e desconhecidas são expressas em moles.

As equações químicas expressam as quantidades de reagentes e produtos em a reagentes e produtos em uma reação. Os coeficientes de uma equação balanceada podem representar o número de moléculas ou o número de moles de cada substância. A produção de amônia \ (\ left (\ ce {NH_3} \ right) \) a partir de gases de nitrogênio e hidrogênio é uma importante reação industrial chamada processo de Haber, em homenagem ao químico alemão Fritz Haber.
\
A equação balanceada pode ser analisada de várias maneiras, conforme mostrado na figura abaixo.
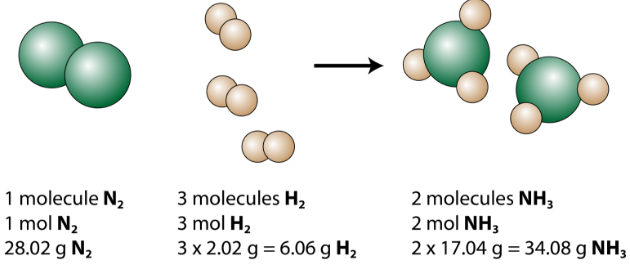
Vemos que 1 molécula de nitrogênio reage com 3 moléculas de hidrogênio para formar 2 moléculas de amônia. Esta é a menor quantidade relativa possível de reagentes e produtos. Para considerar valores relativos maiores, cada coeficiente pode ser multiplicado pelo mesmo número. Por exemplo, 10 moléculas de nitrogênio reagiriam com 30 moléculas de hidrogênio para produzir 20 moléculas de amônia.
A quantidade mais útil para a contagem de partículas é o mol. Portanto, se cada coeficiente é multiplicado por um mol, a equação química balanceada nos diz que 1 mol de nitrogênio reage com 3 moles de hidrogênio para produzir 2 moles de amônia. Esta é a maneira convencional de interpretar qualquer equação química balanceada.
\
A massa e o número de átomos devem ser conservados em qualquer reação química. O número de moléculas não é necessariamente conservado.

Uma razão molar é um fator de conversão que relaciona as quantidades em moles de quaisquer duas substâncias em uma reação química. Os números em um fator de conversão vêm dos coeficientes da equação química balanceada. As seis razões molares a seguir podem ser escritas para a reação de formação de amônia acima.
Em um problema de razão molar, a substância dada, expressa em moles, é escrita primeiro. O fator de conversão apropriado é escolhido a fim de converter de moles da substância dada em moles do desconhecido.