Mysz C57BL / 6 nie istnieje!
Bardzo ważne jest, aby wiedzieć, jakiego konkretnego podszczepu C57BL / 6 używasz, abyś używał odpowiednich kontrolek do swoich eksperymentów i poprawnie interpretował dane! Ponieważ C.C. Little (założyciel The Jackson Laboratory) początkowo wygenerował wsobny szczep C57BL w latach 1920-1930, wsobny podras C57BL / 6 stał się najczęściej używanym szczepem myszy w badaniach biomedycznych. Popularność myszy wsobnych C57BL / 6 doprowadziła do powstania wielu kolonii u różnych dostawców i instytucji akademickich na całym świecie.
Pododmiany C57BL / 6
Możesz nie wiedzieć tego: każdy gdy nowa kolonia C57BL / 6 jest utrzymywana oddzielnie od istniejącej kolonii przez 20 lub więcej pokoleń, staje się nowym podszczepem C57BL / 6. Pokolenia kumulują się, więc jeśli każda z dwóch oddzielnych kolonii rozmnaża się przez 10 pokoleń (~ 2-3 lata), są one oddalone od siebie o 20 pokoleń i mają różne pododmiany o potencjalnie różnych fenotypach. W ramach nomenklatury szczepu kody laboratoryjne są dodawane na końcu jako oznaczenie podszczepu. C57BL / 6J jest rodzicielską odmianą podrzędną; „J” jest kodem laboratoryjnym The Jackson Laboratory. Dlatego nie ma źródła myszy „C57BL / 6”; zawsze istnieje dłuższe oznaczenie dla każdego podszczepu, wskazujące instytut lub laboratorium, które utrzymuje różne kolonie.
Podszczepy C57BL / 6 nie są takie same!
Raz nowy podszczep C57BL / 6 zostanie ustalona, spontaniczne mutacje pojawią się zarówno w pierwotnej kolonii, jak iw nowej kolonii. Część tych mutacji rozprzestrzeni się w kolonii przez dryf genetyczny i zostanie utrwalona (homozygotyczna u wszystkich myszy). Im dłużej poszczególne pododmiany są od siebie oddzielone, tym większa jest liczba różnic genetycznych między nimi. Te różnice genetyczne mogą prowadzić do różnic fenotypowych.
C57BL / 6J vs. C57BL / 6N
W 1951 roku myszy C57BL / 6J wysłano do National Institutes of Health (NIH), gdzie założono kolonię i nazwano ją C57BL / 6N. Następnie z kolonii C57BL / 6N wyprowadzono wiele podszczepów. Stwierdzono, że mutacja powodująca plamistą degenerację siatkówki, znana jako Crb1rd8, jest homozygotyczna we wszystkich podszczepach spokrewnionych z C57BL / 6N, ale nie występuje w podszczepie C57BL / 6J. Ponadto dane zebrane z centrów fenotypowania International Knockout Mouse Consortium (IKMC) wykazały liczne różnice fenotypowe między pododmianami C57BL / 6J i C57BL / 6N.
Niebezpieczeństwa związane z wpadnięciem w pułapkę ignorancji
Mogą wystąpić poważne konsekwencje, jeśli nie jesteś w pełni świadomy tła genetycznego (szczepu i podgrupy) lub swoich eksperymentalnych myszy. Nie byłbyś pierwszym badaczem, który wpadłby w tę pułapkę. Wybierając niewłaściwy szczep kontrolny, istnieje duże ryzyko błędnej interpretacji danych, wyciągnięcia błędnych wniosków i poważnego opóźnienia programu badawczego.
Nasz post na blogu „Dlaczego laboratorium badawcze Harvarda zajęło 2 lata, aby wrócić do badań” opisuje, w jaki sposób laboratorium badawcze przypadkowo połączyło fenotyp niedoboru odporności z allelem nokautowym, podczas gdy w rzeczywistości było to spowodowane mutacji w konkretnym podszczepie C57BL / 6, z którym krzyżowano wstecznie nokaut. Błąd został wykryty, gdy model nokautu został krzyżowany wstecznie z podszczepem C57BL / 6 od innego dostawcy i fenotyp został utracony. W większości przypadków wysiłek, a zasoby użyte do wyjaśnienia, dlaczego zespół nie mógł powtórzyć poprzednich wyników, mogłyby zostać zapisane, gdyby autorzy użyli myszy kontrolnych z tym samym tłem genetycznym – jak ta, której użyto do krzyżowania wstecznego modelu knockout będącego przedmiotem zainteresowania.
Czy ten gen jest ochronny czy toksyczny?
Inny znaczący przykład pochodzi z laboratorium w National Heart, Lung, and Blood Institute (część NIH). Po przetestowaniu wpływu nokautu Mapk9 (Jnk2) na acetaminofen indukowane uszkodzenie wątroby przy użyciu C57BL / 6J jako kontroli typu dzikiego wyniki były sprzeczne z oczekiwaniami. Po powtórzeniu z użyciem C57BL / 6NJ (C57BL / 6N importowanego do JAX z NIH w 2005 r.) Jako kontroli typu dzikiego, fenotyp nokautów Mapk9 znajdował się pomiędzy fenotypem C57BL / 6J i C57BL / 6NJ (patrz rysunek).
Badacze znaleźli się w sytuacji, w której mogli zinterpretować swoje dane na dwa przeciwstawne sposoby, w zależności od zastosowanej kontroli. Jeśli jako kontrole zastosowano C57BL / 6J, dane wskazywały, że MAPk9 jest hepatoprotekcyjny. Jeśli użyli C57BL / 6NJ jako kontroli, to MAPK9 wydawało się być hepatotoksyczne.
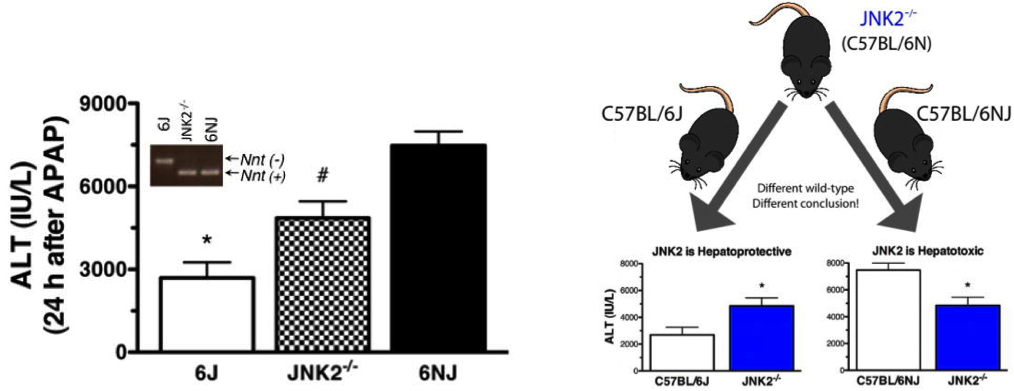
Rysunek 1. Wnioski z danych różnią się w zależności od wyboru szczepu kontrolnego. Myszy traktowano acetaminofenem (APAP, 300 mg / kg dootrzewnowo). Uszkodzenie wątroby oceniano 24 godziny po leczeniu przez pomiar aktywności aminotransferazy alaninowej (ALT) w surowicy.
Na szczęście naukowcy byli w stanie ustalić, że nokaut Mapk9 był na tle C57BL / 6N i doszli do wniosku, że gen był hepatotoksyczny.Pomyśl jednak, jak łatwo te dane mogły zostać błędnie zinterpretowane i jak często takie błędy są całkowicie pomijane, co prowadzi do niemożliwych do odtworzenia wyników!
Dlatego należy być ostrzeżonym i upewnić się, że znasz nie tylko szczep wsobny, ale pododmian myszy, których używasz do eksperymentów, więc wybierasz właściwe kontrole i generujesz wiarygodne i znaczące dane. Pamiętaj, nie ma czegoś takiego jak odmiana myszy C57BL / 6, zawsze istnieje dłuższa nazwa!