9.9 Wprowadzenie do syntezy organicznej
Cel
Po ukończeniu tej sekcji powinieneś być w stanie zaprojektować wieloetapową syntezę przygotować dany produkt z danego materiału wyjściowego, korzystając z dowolnej reakcji przedstawionej w podręczniku do tego momentu.
Uwagi do studium
Powinieneś Zauważyli, że niektóre z przypisanych im problemów wymagały połączenia szeregu reakcji organicznych w celu przekształcenia jednego związku organicznego w inny, gdy nie ma jednej reakcji prowadzącej do osiągnięcia tego celu. Taki ciąg reakcji nazywany jest „syntezą organiczną”. Jednym z głównych celów tego kursu jest pomoc w projektowaniu takich syntez. Aby osiągnąć ten cel, wszystkie reakcje opisane w kursie będą dostępne w Twojej pamięci. Niektóre reakcje będziesz musiał przywoływać znacznie częściej niż inne, a jedynym sposobem na opanowanie tego celu jest praktyka. Przykłady podane w tym rozdziale będą stosunkowo proste, ale wkrótce przekonasz się, że możesz opracować dość wyrafinowane syntezy, używając ograniczonej liczby podstawowych reakcji.
Badanie chemii organicznej naraża studenta na szereg wzajemnie powiązanych reakcji. Na przykład alkeny można przekształcić w strukturalnie podobne alkany, alkohole, halogenki alkilu, epoksydy, glikole i borany; rozszczepione do mniejsze aldehydy, ketony i kwasy karboksylowe; i powiększone przez karbokation i rodniki, a także cykloaddycje. Wszystkie te produkty mogą być następnie przekształcane w wiele nowych związków zawierających wiele różnych różnych grup funkcyjnych, a tym samym otwarte na dalsze rozwinięcie. W konsekwencji logiczna koncepcja wieloetapowej syntezy do budowy określonego związku z określonego materiału wyjściowego staje się jednym z najtrudniejszych problemów, jakie można postawić.
Jedno- lub dwuetapowa sekwencja prostych reakcji to nie jest to trudne do wywnioskowania. Jeśli, na przykład, ktoś zostanie poproszony o przygotowanie mezo-3,4-heksanodiolu z 3-heksynu, większość studentów zdaje sobie sprawę, że przed rozpoczęciem tworzenia glikolu konieczne będzie zredukowanie alkinu do cis lub trans-3-heksenu. Hydroksylowanie perganianu lub tetratlenku osmu cis-3-heksenu mogłoby utworzyć pożądany izomer mezo. Z trans-3-heksenu należałoby najpierw epoksydować alken nadtlenokwasem, a następnie otworzyć pierścień jonem wodorotlenowym. Ten przykład ilustruje wspólną cechę syntezy: często istnieje więcej niż jedna skuteczna procedura prowadząca do pożądanego produktu.
Dłuższe, wieloetapowe syntezy wymagają starannej analizy i przemyślenia, ponieważ należy rozważyć wiele opcji. Podobnie jak szachista ekspert oceniający dalekosiężne wady i zalety potencjalnych ruchów, chemik musi ocenić potencjalny sukces różnych możliwych ścieżek reakcji, koncentrując się na zakresie i ograniczeniach ograniczających każdą z zastosowanych reakcji. Może to być trudne zadanie, którego umiejętności nabywa się poprzez doświadczenie, często metodą prób i błędów.
Trzy poniższe przykłady mają charakter ilustracyjny. Pierwszy to prosty problem konwersji grup funkcyjnych, który początkowo może wydawać się trudny. Często pomocne jest rozwiązanie takich problemów wstecz, zaczynając od produktu. W tym przypadku powinno być oczywiste, że cykloheksanol można zastąpić cykloheksanonem, ponieważ ten ostatni można następnie wytworzyć przez proste utlenianie. Ponadto, ponieważ cykloheksan (i ogólnie alkany) jest stosunkowo niereaktywny, bromowanie (lub chlorowanie) wydaje się być oczywistym pierwszym krokiem. W tym momencie istnieje pokusa, aby przekształcić bromocykloheksan w cykloheksanol w reakcji SN2 z jonem wodorotlenkowym. Reakcji tej towarzyszyłaby niewątpliwie eliminacja E2, więc czystszym, choć o jeden krok dłużej, byłoby najpierw wytworzyć cykloheksen, a następnie uwodnić go dowolną z kilku metod (np. Oksymercuracja i hydroboracja), w tym metodą pokazaną po kliknięciu na diagram
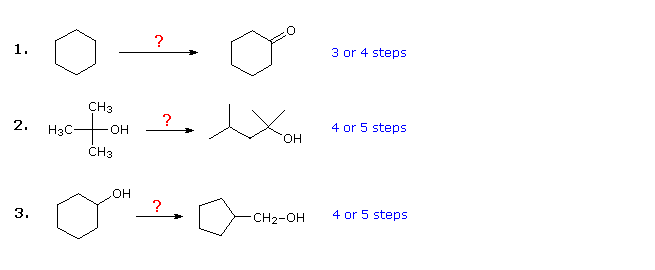 Odpowiedź
Odpowiedź
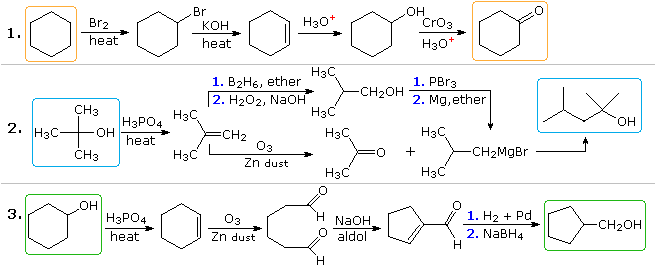
Wiarygodne rozwiązania drugiego i trzeciego problemu również pojawią się powyżej w tym momencie. W zadaniu 2 żądany produkt ma siedem atomów węgla, a materiał wyjściowy cztery. Oczywiście, dwa produkty pośrednie pochodzące ze związku wyjściowego muszą być połączone razem i jeden węgiel musi zostać utracony, albo przed, albo po tym wiązaniu. Funkcja 3º-alkoholu w produkcie sugeruje tworzenie się przez dodatek Grignarda do ketonu, a izobuten wydaje się być dobrym prekursorem każdego z tych reagentów, jak pokazano. Związki reagentów i produktów w trzecim problemie są izomerami, ale do wystąpienia tej zmiany strukturalnej niezbędny jest pewien rodzaj sekwencji zrywania i tworzenia wiązań. Jedną możliwą procedurę przedstawiono powyżej. Może również służyć katalizowane kwasem przegrupowanie tlenku cykloheksenu, a następnie redukcja.
Przydatne podejście do opracowywania syntez, zaczynając od cząsteczki docelowej i pracując wstecz w kierunku prostszych materiałów wyjściowych, zostało sformalizowane przez prof. E. J. Corey (Harvard) i nazwane analizą retrosyntetyczną. W tej procedurze docelowa cząsteczka jest stopniowo przekształcana w prostsze struktury poprzez rozłączenie wybranych wiązań węgiel-węgiel. Te rozłączenia opierają się na transformatach, które są odwrotnością prawdopodobnych konstrukcji syntetycznych. Każda tak wygenerowana prostsza struktura staje się punktem wyjścia do dalszych rozłączeń, prowadzących do rozgałęzionego zestawu powiązanych ze sobą związków pośrednich. Transformację retrosyntetyczną przedstawia symbol = >, jak pokazano poniżej w poprzednich przykładach 2 & 3. Po przeprowadzeniu pełnej analizy pożądaną syntezę można przeprowadzić przez zastosowanie reakcji leżących u podstaw transformacji.
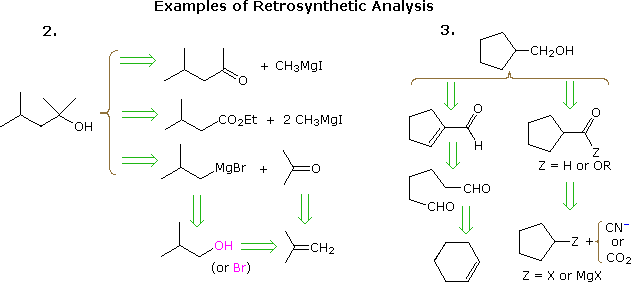
Powyższy diagram nie przedstawia pełnego zestawu transformacji dla tego celu związki. Kiedy określony jest materiał wyjściowy, jak w powyższych problemach, proponowane ścieżki muszą odzwierciedlać to ograniczenie. Zatem opcje 4-metylo-2-pentanonu i estru 3-metylomaślanu w przykładzie 2, chociaż całkowicie rozsądne, nie pasują dobrze do początku tert-butanolu. Podobnie cyklopentylowy związek pośredni może stanowić doskonałą drogę do produktu z przykładu 3, ale nie spełnia określonych warunków problemu.
Analiza retrosyntetyczna jest szczególnie przydatna, gdy rozważa się stosunkowo złożone cząsteczki bez ograniczeń materiału wyjściowego. Jeśli jest prowadzony bez uprzedzeń, czasami pojawiają się niezwykłe i intrygujące możliwości. Niestety, złożoność molekularna (złożona z rozmiaru, funkcjonalności, wbudowania heteroatomów, cyklicznych połączeń i stereoizomerii) generalnie prowadzi do bardzo dużych i rozległych rozgałęzionych drzew transformacyjnych. Analiza wspomagana komputerowo okazała się pomocna, ale ostatecznie instynkty i doświadczenie chemika odgrywają kluczową rolę w opracowaniu udanego planu syntezy. Poniżej przedstawiono kilka stosunkowo prostych przykładów, z których większość ma ograniczenia dotyczące materiału początkowego.
Ćwiczenia
Pytania
Q9.9.1
Zaczynając od 3-heksynu, przewiduj trasy syntezy do osiągnięcia:
A – cis-3-heksen
B – 3,4-dibromoheksan
C – 3-heksanol
Q9.9.2
Wychodząc z acetylenu i dowolnych halogenków alkilu, proponuje się syntezę w celu wytworzenia (a) pentanalu i (b) heksanu.
Rozwiązania
S9.9.1

S9.9.2
.png?revision=1)
Współtwórcy i atrybucje
-
Dr. Dietmar Kennepohl FCIC (profesor chemii, Uniwersytet Athabasca)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, emerytowany profesor (Michigan State U.), wirtualny podręcznik chemii organicznej