12.2: Stosunki molowe
Stosunki molowe
Problemy stechiometryczne można scharakteryzować dwoma rzeczami: (1) informacjami podanymi w zadaniu (2) informacje, które mają zostać rozwiązane, określane jako nieznane. Zarówno dane, jak i nieznane mogą być zarówno reagentami, jak i produktami, lub jeden może być reagentem, a drugi produktem. Ilości substancji można wyrazić w molach. Jednak w warunkach laboratoryjnych często określa się ilość substancji na podstawie jej masy w gramach. Ilość substancji gazowej można wyrazić jej objętością. W tej koncepcji skupimy się na typie problemu, w którym zarówno dane, jak i nieznane wielkości są wyrażone w molach.

Równania chemiczne wyrażają ilości reagentów i produktów w reagenty i produkty reakcji. Współczynniki zbilansowanego równania mogą reprezentować liczbę cząsteczek lub liczbę moli każdej substancji. Produkcja amoniaku \ (\ left (\ ce {NH_3} \ right) \) z azotu i wodoru jest ważną reakcją przemysłową zwaną procesem Habera od nazwiska niemieckiego chemika Fritza Habera.
\
Zbilansowane równanie można analizować na kilka sposobów, jak pokazano na poniższym rysunku.
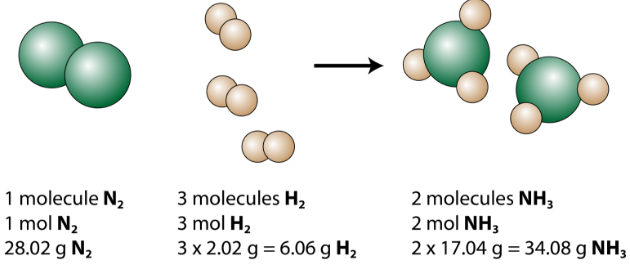
Widzimy, że 1 cząsteczka azotu reaguje z 3 cząsteczkami wodoru, tworząc 2 cząsteczki amoniaku. Są to najmniejsze możliwe względne ilości reagentów i produktów. Aby wziąć pod uwagę większe ilości względne, każdy współczynnik można pomnożyć przez tę samą liczbę. Na przykład 10 cząsteczek azotu zareagowałoby z 30 cząsteczkami wodoru, tworząc 20 cząsteczek amoniaku.
Najbardziej użyteczną ilością do liczenia cząstek jest mol. Więc jeśli pomnożymy każdy współczynnik przez mol, zbilansowane równanie chemiczne mówi nam, że 1 mol azotu reaguje z 3 molami wodoru, tworząc 2 mole amoniaku. Jest to konwencjonalny sposób interpretacji każdego zbilansowanego równania chemicznego.
\
W każdej reakcji chemicznej należy zachować masę i liczbę atomów. Liczba cząsteczek niekoniecznie jest zachowana.

Współczynnik molowy to współczynnik konwersji, który odnosi się do ilości w molach dowolnych dwóch substancji w reakcji chemicznej. Liczby we współczynniku konwersji pochodzą ze współczynników zbilansowanego równania chemicznego. Poniższych sześć stosunków molowych można zapisać dla powyższej reakcji tworzenia amoniaku.
W przypadku problemu z molami dana substancja, wyrażona w molach, jest zapisywana jako pierwsza. Aby przeliczyć liczbę moli danej substancji na mole nieznanego, dobiera się odpowiedni współczynnik konwersji.