Vernieuwde CAR T-celtherapie vermindert bijwerkingen in eerste klinische proef
20 februari 2020, door NCI-personeel
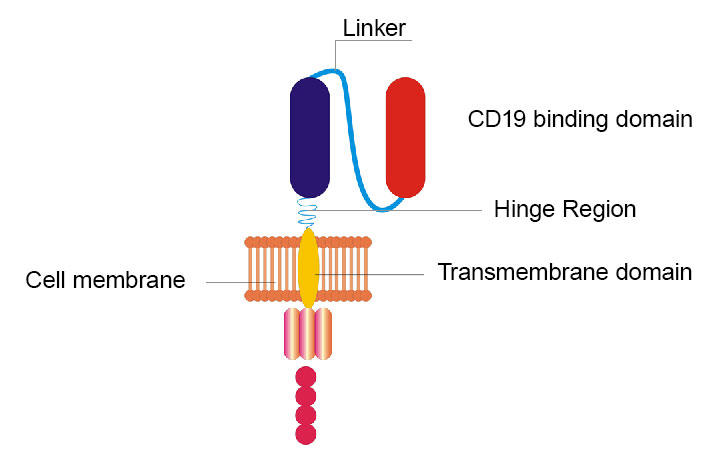
NCI-onderzoekers hebben hun originele CD19 CAR aangepast door het scharnier te vervangen en transmembraandomeinen en het verwisselen van het CD19-bindende domein van een eiwitfragment dat in muizen wordt gevonden naar een vergelijkbaar fragment dat bij mensen wordt aangetroffen.
In de loop van tientallen jaren hebben NCI-wetenschappers een uitgebreide basis gelegd voor een roman behandeling die uiteindelijk axicabtagene ciloleucel (Yescarta) zou worden, een CAR T-celtherapie voor volwassenen met lymfoom.
Hoewel de therapie kan leiden tot langdurige remissies bij sommige patiënten met zeer vergevorderde kanker, kan het ook neurologische bijwerkingen veroorzaken, zoals spraakproblemen, tremoren, delirium en toevallen. Sommige bijwerkingen kunnen ernstig of fataal zijn.
Daarom hebben NCI-onderzoekers in 2017 hun oorspronkelijke CAR T-cel-ontwerp aangepast met als doel een veiligere en effectievere therapie te creëren. Nu suggereren de resultaten van de eerste klinische proef met de vernieuwde CAR T-cellen dat ze mogelijk een deel van hun doel hebben bereikt.
De nieuwe therapie veroorzaakte veel minder neurologische bijwerkingen dan de oorspronkelijke therapie in een eerdere proef, toch was het even effectief. De bevindingen werden op 20 januari gerapporteerd in Nature Medicine.
“Het is opmerkelijk dat van de 20 patiënten in dit onderzoek er slechts één ernstige neurologische bijwerkingen had”, zei associate-onderzoeker Jennifer Brudno, MD, van NCIs Center for Kankeronderzoek.
“Dit lijkt een aanzienlijke vooruitgang te zijn in ons huidige begrip van hoe CAR T-cellen werken en hoe CAR T veiliger kan worden gemaakt”, aldus David Maloney, MD, Ph.D., Medical directeur cellulaire immunotherapie voor Fred Hutchinson Cancer Research Center, die niet bij het onderzoek betrokken was.
De studie is echter beperkt door het kleine aantal betrokken patiënten en de relatief korte tijd dat de uitkomsten van de patiënt zijn bijgehouden, voegde hij eraan toe.
T-cellen krijgen een nieuwe auto
CAR T-celtherapie omvat het bewapenen van de eigen T-cellen (een soort witte bloedcel) van een patiënt met een gespecialiseerd eiwit dat CAR of chimeer wordt genoemd antigeen receptor. Deze receptor helpt de T-cellen de kanker van de persoon te vinden en te doden.
De vernieuwde CAR van het NCI-team verschilt in een aantal opzichten van het origineel. Zo werden twee secties (de scharnier- en transmembraandomeinen genoemd) van de oorspronkelijke CAR vervangen. En een ander gedeelte dat oorspronkelijk bestond uit een eiwitfragment dat bij muizen werd gevonden, werd geruild voor een vergelijkbaar fragment dat bij mensen werd aangetroffen. Maar, net als het origineel, richt de nieuwe CAR zich ook op CD19, een molecuul dat het oppervlak van lymfoomcellen bestrijkt.
In eerdere laboratoriumstudies ontdekten de onderzoekers dat T-cellen gewapend met de nieuwe CAR de groei van tumoren bij muizen vertraagden. En vergeleken met de originele CAR T-cellen produceerden de nieuwe CAR T-cellen lagere niveaus van stoffen die cytokines worden genoemd.
Wetenschappers begrijpen niet volledig hoe CAR T-cellen neurologische bijwerkingen veroorzaken, maar cytokines kunnen gedeeltelijk de schuld geven. Cytokinen zijn ook de boosdoener van het cytokine-release-syndroom, een andere mogelijk levensbedreigende bijwerking van CAR T-celtherapie.
Met deze veelbelovende resultaten ging het team verder met een eerste studie bij mensen van de vernieuwde CAR T-cellen.
Minder cytokinen, minder neurologische bijwerkingen
In de nieuwe studie gaven Dr. Brudno en haar collegas de nieuwe CAR T-celtherapie aan 20 patiënten met B-cellymfoom.
In totaal ondervonden vier patiënten (20%) enige neurologische toxiciteit: drie hadden milde effecten en één (5%) ervoer ernstige effecten die snel verdwenen na behandeling met een steroïde (geneesmiddel dat het immuunsysteem onderdrukt ).
In een eerdere studie van de oorspronkelijke CAR T-celtherapie waarbij 22 mensen met B-cellymfoom betrokken waren, ondervonden 17 (77%) enige neurologische toxiciteit – waaronder 11 patiënten (50%) die ernstige symptomen vertoonden.
Twee patiënten (10%) in het nieuwe onderzoek en vier (18%) in het eerdere onderzoek hadden een ernstig cytokine-release-syndroom. “Het lijkt gunstig dat vergelijkbaar is, maar het is moeilijk te zeggen of het zeker minder frequent is” met de nieuwe therapie, zei Dr. Brudno.
Cytokinespiegels waren lager in het bloed van patiënten die met de nieuwe therapie werden behandeld. dan bij patiënten die de oorspronkelijke therapie kregen, vonden de wetenschappers, wat zou kunnen verklaren waarom de nieuwe therapie minder neurologische bijwerkingen veroorzaakte, schreven ze.
In beide onderzoeken gebruikten de onderzoekers dezelfde methoden om de ernst te beoordelen van neurologische toxiciteit en het cytokine-afgiftesyndroom, merkte Dr. Brudno op.
En hoewel er andere overeenkomsten zijn tussen de twee onderzoeken – ze werden bijvoorbeeld in dezelfde faciliteit uitgevoerd – is het lastig om de resultaten van onafhankelijke onderzoeken te vergelijken, zei ze.
CAR T-cellen die blijven hangen
Een probleem met de huidige CAR T-celtherapieën is dat de cellen niet erg lang meegaan in het lichaam van de patiënt. Dat komt gedeeltelijk omdat het menselijke immuunsysteem muizeneiwitten als onbekend kan zien en de CAR T-cellen kan vernietigen.
Een deel van het doel van het team was om CAR T-cellen te maken die langer blijven hangen of blijven bestaan. Ze redeneerden dat T-cellen met een CAR gemaakt van alle menselijke eiwitten langer meegaan dan cellen met een CAR die muizeneiwitten bevat.
Als het immuunsysteem van de patiënt een CAR negeert die gemaakt is van menselijke eiwitten, dan kunnen de CAR T-cellen langer meegaan en effectiever zijn, legt Dr. Brudno uit.
Dat kan het geval zijn voor de nieuwe therapie. Een maand na ontvangst van de behandeling waren er hogere niveaus van CAR T-cellen in het bloed van patiënten die de nieuwe therapie kregen dan bij degenen die met de oorspronkelijke therapie waren behandeld.
Deze bevindingen zijn bemoedigend en zouden moeten worden onderzocht in toekomstige studies, zei Dr. Maloney.
Hoewel de nieuwe CAR T-cellen langer lijken te blijven bestaan dan de oorspronkelijke CAR T-cellen, bleken ze niet effectiever te zijn. In beide onderzoeken bleek meer dan de helft (55%) van de deelnemers ging in volledige remissie.
Maar het is “bemoedigend” om te zien “naast de lage toxiciteit” een zeer goede werkzaamheid van dit CAR T-celproduct, “Dr. Brudno zei.
Een informatief herontwerp
CAR T-celtherapie kan leiden tot een breed scala aan neurologische effecten, variërend van zeer mild tot ernstig en levensbedreigend, legde Dr. Brudno uit.
Deze bijwerkingen zijn geassocieerd met alle momenteel beschikbare CAR T-celtherapieën – twee die door de FDA zijn goedgekeurd en een andere in afwachting van goedkeuring door de FDA – merkte dr. Maloney op. de mate van ernstige neurologische toxiciteit varieerde van 5% tot 50%.
Andere klinische onderzoeken testen CAR T-celtherapieën die ook opnieuw zijn ontworpen om veiliger te zijn, merkte Dr. Maloney op. De nieuwe NCI-studie identificeert aspecten van het CAR T-celontwerp waarvan voorheen niet bekend was dat ze de neurologische toxiciteit beïnvloeden, zei hij.
“Maar hoe je dat vertaalt in een nieuw commercieel product of een commercieel product upgraden, is een heel andere vraag”, zei hij. Het vervaardigen van een CAR T-celtherapie voor elke individuele patiënt is een complex en duur proces dat kan alleen worden gedaan in zeer gespecialiseerde faciliteiten.
Voorlopig richt het NCI-team, geleid door James Kochenderfer, MD, zich op het uitvoeren van klinische onderzoeken naar verschillende CAR T-celtherapieën voor mensen met een ander type bloed kanker, multipel myeloom.