Frontiers in Human Neuroscience
Inleiding
Bewustzijn is een opwinding en bewustwording van de omgeving en het zelf, dat wordt bereikt door de werking van het Ascending Reticulaire Activeringssysteem (ARAS) op de hersenstam en de hersenschors (Daube, 1986; Paus, 2000; Zeman, 2001; Gosseries et al., 2011). De ARAS is samengesteld uit verschillende neuronale circuits die de hersenstam met de cortex verbinden. Deze neuronale verbindingen vinden voornamelijk hun oorsprong in de reticulaire vorming (RF) van de hersenstam en projecteren via synaptische relais in de intralaminaire kern van de thalamus naar de hersenschors (Daube, 1986; Paus, 2000; Zeman, 2001; Afifi en Bergman, 2005; Gosseries). et al., 2011). Bovendien zijn verschillende hersenstamkernen (locus coeruleus, dorsale raphe, mediaan raphe, pedunculopontine nucleus, parabrachiale nucleus), niet-specifieke thalamuskernen, hypothalamus en basale voorhersenen ook opgenomen in het ARAS-systeem (Aston-Jones et al., 2001 ; Parvizi en Damasio, 2003; Fuller et al., 2011). Een grondige evaluatie van de ARAS is belangrijk voor de diagnose en behandeling van patiënten met een verminderd bewustzijn, zoals patiënten die in een vegetatieve toestand verkeren of die met een minimaal bewustzijn (Zeman, 2001; Gosseries et al., 2011).
Conventionele MRI van de hersenen, functionele neuroimaging-technieken, elektrofysiologische methoden en MR-spectroscopie zijn gebruikt in studies van de ARAS in het menselijk brein (Parvizi en Damasio, 2003; Schiff, 2006; Tshibanda et al., 2009, 2010; Gawryluk et al. ., 2010). Omdat de ARAS echter niet duidelijk kan worden onderscheiden van aangrenzende neurale structuren, kan nauwkeurige identificatie en schatting van de ARAS in het menselijk brein problematisch zijn bij het gebruik van deze methoden. Daarentegen maakt diffusion tensor imaging (DTI) evaluatie van witte materie mogelijk vanwege het vermogen ervan om waterdiffusiekenmerken af te beelden (Mori et al., 1999). In normale witte stof hebben watermoleculen relatieve bewegingsvrijheid parallel aan zenuwvezelkanalen. Hun bewegingen zijn echter beperkt over kanalen, wat aanleiding geeft tot diffusie-anisotropie van witte stof. Dienovereenkomstig is diffusie-anisotropie gebruikt voor de evaluatie van de mate van vezelverandering in witte stof (Chang et al., 2010; Puig et al., 2010). Verschillende recente onderzoeken hebben geprobeerd het nut van DTI aan te tonen voor de evaluatie van laesies bij patiënten met een verminderd bewustzijn en connectiviteit van specifieke ARAS-kernen in het menselijk brein (Voss et al., 2006; Perlbarg et al., 2009; Tollard et al., 2009; Tshibanda et al., 2009; Fernandez-Espejo et al., 2010, 2011; Newcombe et al., 2010; Edlow et al., 2012). Er is echter weinig bekend over de hele reconstructie en schatting van de ARAS in het menselijk brein (Edlow et al., 2012).
In de huidige studie hebben we met behulp van DTI geprobeerd de onderste enkele component te reconstrueren. van de ARAS van de pontine RF naar de intralaminaire kernen van de thalamus in de normale menselijke hersenen.
Materialen en methoden
Proefpersonen
Zesentwintig normale gezonde proefpersonen (14 mannen, 12 vrouwen; gemiddelde leeftijd 31,85 ± 9,80 jaar; bereik 20-50) zonder voorgeschiedenis van neurologische aandoeningen werden gerekruteerd voor deze studie. Alle proefpersonen namen als vrijwilliger deel aan dit onderzoek en gaven schriftelijke toestemming voordat ze een DTI-scan ondergingen. De studie werd goedgekeurd door de institutionele beoordelingsraad van ons ziekenhuis.
Diffusion Tensor Image
DTI-gegevens werden verkregen met behulp van een 6-kanaals kopspoel op een 1,5-T Philips Gyroscan Intera ( Philips, Best, Nederland) met echoplanaire beeldvorming met één opname. Voor elk van de 32 niet-collineaire diffusiesensibiliserende gradiënten hebben we 67 aangrenzende plakjes verkregen parallel aan de anterieure commissuur-posterieure commissuurlijn. Beeldvormingsparameters waren als volgt: acquisitiematrix = 96 × 96, gereconstrueerd tot matrix = 128 × 128, gezichtsveld = 221 mm × 221 mm, TR = 10.726 ms, TE = 76 ms, reductiefactor parallelle beeldvorming (SENSE-factor) = 2, EPI-factor = 49, en b = 1000 s / mm2, NEX = 1, en een plakdikte van 2,3 mm (verworven isotrope voxelgrootte 2,3 mm × 2,3 mm × 2,3 mm).
Probabilistische vezel Tracking
Analyse van diffusie-gewogen beeldgegevens werd uitgevoerd met behulp van de Oxford Center for Functional Magnetic Resonance Imaging of the Brain (FMRIB) Software Library (FSL; www.fmrib.ox.ac.uk/fsl). Affine multi-scale tweedimensionale registratie werd gebruikt voor correctie van het bewegingseffect van het hoofd en beeldvervorming als gevolg van wervelstroom. Het volgen van vezels werd uitgevoerd met behulp van een probabilistische tractografiemethode op basis van een multifibermodel en toegepast in de huidige studie met behulp van tractografieroutines geïmplementeerd in FMRIB Diffusion (5000 stroomlijnmonsters, staplengtes van 0,5 mm, krommingsdrempels = 0,2) (Smith et al., 2004 ).Voordelen van probabilistische tractografie, die in deze studie werd gebruikt, zijn onder meer een grotere robuustheid tegen ruis, evenals het vermogen om paden met scherpere hoeken te detecteren en om kruisende vezels te onderscheiden (Behrens et al., 2007; Winston et al., 2011).
De route van de ARAS werd bepaald door selectie van vezels die door zaadregios van belang (ROI) en doel (beëindiging) ROIs gaan. Een zaad-ROI werd op de RF van de pons geplaatst ter hoogte van de ingangszone van de trigeminuszenuw (Daube, 1986; Afifi en Bergman, 2005). Analyse van de mediale lemniscus en rubrospinale tractus werd uitgevoerd om de grens van de RF op de pons te bevestigen (Figuur 1A). Voor analyse van de mediale lemniscus werden zaad-ROIs op de anteromediale medulla geplaatst en de doel-ROI werd op de somatosensorische cortex geplaatst (Hong et al., 2010). Voor analyse van het rubrospinale kanaal werden zaad-ROIs op de rode kern geplaatst en de doel-ROI werd op het contralaterale dorsolaterale gebied van de medulla (Monakows gebied) geplaatst (Nathan en Smith, 1982; Kwon et al., 2011). De beoogde ROI werd gegeven op de intralaminaire kernen van de thalamus ter hoogte van het commissurale vlak (Morel, 2007). Bij het definiëren van de intralaminaire kernen van de thalamus verwezen we naar een hersenatlas (Morel, 2007) (Figuur 1A). Van 5000 monsters die uit de zaadvoxel waren gegenereerd, werden de resultaten voor contact gevisualiseerd bij een drempelwaarde van minimaal 1, gestroomlijnd door elke voxel voor analyse. Waarden van fractionele anisotropie (FA), gemiddelde diffusiteit (MD) en kanaalnummer van de onderste enkele component van ARAS werden gemeten.
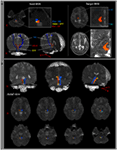
Figuur 1. (A) Zaadgebieden van belang (ROI) worden gegeven op de pontine reticulaire formatie (rode kleur). De doel-ROI wordt gegeven op de intralaminaire kernen van de thalamus ter hoogte van het commissurale vlak. De grens van de intralaminaire kernen van de thalamus werd bepaald aan de hand van het tekstboek van de hersenatlas (Morel, 2007). ML, mediale lemniscus; RST, rubrospinale tractus; RF, reticulaire formatie; AC, anterieure commissuur; PC, achterste commissuur. (B) Paden van het gereconstrueerde opgaande reticulaire activeringssysteem worden weergegeven op elk niveau van de hersenen bij een normaal onderwerp (26-jarige man).
Statistische analyse
SPSS-software (v.15.0; SPSS, Chicago, IL, VS) werd gebruikt voor gegevensanalyse. Gepaarde t-test werd gebruikt voor het bepalen van het verschil in waarden van DTI-parameters van de ARAS tussen de rechter- en linkerhersenhelft. De Pearson-correlatietest werd gebruikt voor het bepalen van de correlatie tussen DTI-parameters van de ARAS en leeftijd. De resultaten werden als significant beschouwd wanneer de p-waarde < 0,05 was.
Resultaten
We reconstrueerden de onderste enkele component van de ARAS tussen de pontine RF en intralaminaire kernen van de thalamus. De gereconstrueerde component van de ARAS was afkomstig van de pontine RF, steeg op door het mesencefale tegmentum net posterieur van de rode kern en eindigde bij alle proefpersonen op de intralaminaire kernen van de thalamus op het niveau van het commissurale vlak (Figuur 1B). / p>
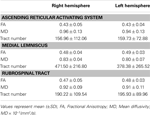
Tabel 1. Diffusietensorbeeldvormingsparameters van het oplopende reticulaire activeringssysteem .
Discussie
In de huidige studie hebben we met behulp van DTI een van de belangrijkste routes van de ARAS, de onderste enkele component van de ARAS van de RF naar de thalamus bij normale proefpersonen, hoewel de ARAS bestaat uit extra hersenstamkernen, hypothalamus, basale voorhersenen en thalamocorticale projecties naar de hersenschors. We selecteerden twee ROIs voor reconstructie van de onderste enkele component van de ARAS: de zaad-ROI, de RF van de pons op het niveau van de ingangszone van de trigeminuszenuw (Daube, 1986; Afifi en Bergman, 2005), en het doelwit. ROI, die de intralaminaire kernen van de thalamus (de centrale laterale kernen, centromedische / parafasciculaire kernen en paracentrale kernen) omvatte op het niveau van het commissurale vlak (Morel, 2007). Het rostrale deel van de RF van de hersenstam boven de ingangszone van de trigeminuszenuw staat bekend als de ARAS; in tegenstelling hiermee is het caudale deel van de RF betrokken bij motorische en autonome functie gerelateerd aan hart- en ademhalingsfunctie (Daube, 1986). Daarom hebben we de zaad-ROI in de RF op het niveau van de ingangszone van de trigeminuszenuw geplaatst. We plaatsten de doel-ROI in de intralaminaire kernen, die de belangrijkste kernen zijn van de ARAS onder de niet-specifieke thalamische kernen. Daarom zijn we van mening dat, omdat we de andere thalamische kernen die betrokken zijn bij de ARAS niet konden opnemen, de onderste enkele component van de ARAS die in de huidige studie werd gereconstrueerd niet de volledige onderste enkele component van de ARAS is, maar het belangrijkste deel van de ARAS. gehele onderste enkele component van de ARAS.Bijgevolg was de onderste enkele component van de ARAS afkomstig van de pontine RF, steeg op door het mesencefale tegmentum posterieur naar de rode kern en eindigde vervolgens op de intralaminaire kernen van de thalamus. Bovendien verschilden de waarden voor de FA-, MD- en tractnummers van de gereconstrueerde onderste enkele component van de ARAS niet significant tussen de rechter- en linkerhersenhelft. Het kanaalnummer wordt bepaald door het aantal voxels in een zenuwstelsel (Kwak et al., 2010). De FA-waarde geeft de mate van directionaliteit en integriteit aan van microstructuren van witte stof zoals axonen, myeline en microtubuli, en de ADC-waarde geeft de omvang van waterdiffusie aan (Assaf en Pasternak, 2008).
Verschillende onderzoeken hebben de klinische bruikbaarheid van DTI aangetoond door enkele gebieden van de onderste enkele component van de ARAS te schatten van de RF tot de thalamus bij patiënten met een verminderd bewustzijn (Perlbarg et al., 2009; Tollard et al., 2009; Newcombe et al., 2010; Fernandez-Espejo et al., 2011). Tollard et al. (2009) rapporteerden over het nut van DTI, dat werd uitgevoerd in het subacute stadium voor het voorspellen van de uitkomst bij 45 patiënten met ernstig TBI (traumatisch hersenletsel) (geen respons op eenvoudige bevelen). In hun studie maten ze de FA-waarde op verschillende supratentoriale en infratentoriale gebieden, waaronder de anterieure pons, posterieure pons en middenhersenen, en toonden aan dat de afname van infratentoriale en supratentoriale FA, behalve in de posterieure pons, het voorspellen van ongunstige uitkomsten mogelijk maakte. 1 jaar vanaf TBI. Perlbarg et al. (2009), die DTI-scanning uitvoerde bij 30 patiënten zonder respons op eenvoudige bevelen na ernstig TBI, rapporteerde een duidelijke afname van FA gemeten in de inferieure longitudinale fasciculus, middenhersenen (cerebrale steel en tegmentum), achterste ledemaat van de interne capsule , en posterieur corpus callosum in de ongunstige uitkomstgroep. Newcombe et al. (2010) gebruikten DTI voor karakterisering van de omvang en locatie van verlies van witte stof bij patiënten die in een vegetatieve toestand waren secundair aan TBI (zeven patiënten) en patiënten met ischemisch-hypoxisch letsel (vijf patiënten). In beide groepen werden afwijkingen in de supratentoriale gebieden waargenomen; Daarentegen werden afwijkingen van de hersenstam alleen waargenomen in de TBI-groep. Fernandez-Espejo et al. (2011) gebruikten DTI bij de differentiatie van de neuropathologie van 25 vegetatieve en minimaal bewuste patiënten. Ze concludeerden dat minimaal bewuste patiënten en patiënten in een vegetatieve toestand verschilden in subcorticale witte stof en thalamische gebieden, maar niet leken te verschillen in de hersenstam. In een recente studie met diffusiebeeldvorming met hoge hoekresolutie, Edlow et al. (2012) rapporteerden over neuroanatomische connectiviteit van de ARAS in het menselijk brein, zowel in vivo als ex vivo. Ze toonden aan dat de connectiviteiten van specifieke ARAS-kernen betrokken waren bij opwinding, en die van thalamische kernen waren betrokken bij modulatie van opwinding.
Concluderend, met behulp van DTI, reconstrueerden we de lagere enkele component van de ARAS van de RF naar de thalamus in het menselijk brein. Wij zijn van mening dat de gebruikte methodologie en de resultaten van deze studie nuttig kunnen zijn voor onderzoekers die de ARAS in het menselijk brein bestuderen. Een van de beperkingen van deze studie is echter dat we niet in staat waren om het hele ARAS-systeem volledig op te helderen, omdat we geen andere thalamus- en hersenstamkernen in onze analyse hebben meegenomen die ook bij de ARAS betrokken zijn. Verdere studies naar de klinische bruikbaarheid van onze bevindingen en studies naar de projecties van de ARAS van de thalamus naar de hersenschors zijn nodig.
Verklaring van belangenconflicten
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder dat er commerciële of financiële relaties waren die zouden kunnen worden opgevat als een mogelijk belangenconflict.
Dankbetuigingen
Dit werk werd ondersteund door de DGIST R & D-programma van het Ministerie van Onderwijs, Wetenschap en Technologie van Korea (13-BD-0401).
Afifi, AK en Bergman, RA (2005). Functionele neuroanatomie: tekst en atlas. New York: Lange Medical Books / McGraw-Hill.
Morel, A. (2007). Stereotactische atlas van de menselijke thalamus en basale ganglia. New York: Informa Healthcare.