12.2: Molverhoudingen
Molverhoudingen
Stoichiometrieproblemen kunnen worden gekenmerkt door twee dingen: (1) de informatie die in het probleem wordt gegeven, en (2) de informatie waarvoor een oplossing moet worden gevonden, de zogenaamde onbekende. Het gegeven en het onbekende kunnen beide reactanten zijn, beide producten, of de een kan een reactant zijn terwijl de andere een product is. De hoeveelheden van de stoffen kunnen worden uitgedrukt in mol. In een laboratoriumsituatie is het echter gebruikelijk om de hoeveelheid van een stof te bepalen door de massa in grammen te bepalen. De hoeveelheid gasvormige stof kan worden uitgedrukt door zijn volume. In dit concept zullen we ons concentreren op het type probleem waarbij zowel de opgegeven als de onbekende grootheden worden uitgedrukt in mollen.

Chemische vergelijkingen geven de hoeveelheden reactanten en producten weer in a reactanten en producten in een reactie. De coëfficiënten van een uitgebalanceerde vergelijking kunnen het aantal moleculen of het aantal mol van elke stof vertegenwoordigen. De productie van ammoniak \ (\ left (\ ce {NH_3} \ right) \) uit stikstof- en waterstofgassen is een belangrijke industriële reactie, het Haber-proces genaamd, naar de Duitse chemicus Fritz Haber.
\
De gebalanceerde vergelijking kan op verschillende manieren worden geanalyseerd, zoals weergegeven in de onderstaande afbeelding.
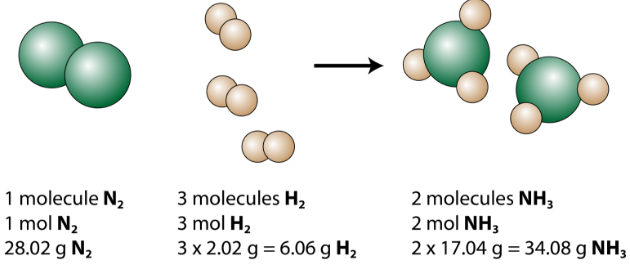
We zien dat 1 molecuul stikstof reageert met 3 moleculen waterstof om 2 moleculen ammoniak te vormen. Dit zijn de kleinst mogelijke relatieve hoeveelheden van de reactanten en producten. Om grotere relatieve bedragen te overwegen, kan elke coëfficiënt worden vermenigvuldigd met hetzelfde getal. 10 moleculen stikstof zouden bijvoorbeeld reageren met 30 moleculen waterstof om 20 moleculen ammoniak te produceren.
De meest bruikbare hoeveelheid voor het tellen van deeltjes is de mol. Dus als elke coëfficiënt met een mol wordt vermenigvuldigd, vertelt de uitgebalanceerde chemische vergelijking ons dat 1 mol stikstof reageert met 3 mol waterstof om 2 mol ammoniak te produceren. Dit is de conventionele manier om een uitgebalanceerde chemische vergelijking te interpreteren.
\
De massa en het aantal atomen moeten in elke chemische reactie behouden blijven. Het aantal moleculen is niet noodzakelijkerwijs behouden.

Een molverhouding is een conversiefactor die de hoeveelheden in mol van twee stoffen in een chemische reactie relateert. De cijfers in een conversiefactor zijn afkomstig van de coëfficiënten van de uitgebalanceerde chemische vergelijking. De volgende zes molverhoudingen kunnen worden geschreven voor de ammoniakvormende reactie hierboven.
Bij een probleem met de molverhouding wordt de gegeven stof, uitgedrukt in mol, eerst geschreven. De juiste omrekeningsfactor wordt gekozen om te converteren van molen van de gegeven stof naar mollen van het onbekende.