12.2 : 몰비
몰비
화학 양론 문제는 다음 두 가지로 특성화 될 수 있습니다. (1) 문제에 제공된 정보, 그리고 (2) 미지수라고하는 해결해야 할 정보. 주어진 것과 알려지지 않은 것은 모두 반응물이거나, 둘 다 생성물이거나, 하나는 반응물이고 다른 하나는 생성물 일 수있다. 물질의 양은 몰로 표현할 수 있습니다. 그러나 실험실 상황에서는 질량을 그램 단위로 찾아서 물질의 양을 결정하는 것이 일반적입니다. 기체 물질의 양은 부피로 표현할 수 있습니다. 이 개념에서는 주어진 양과 알 수없는 양이 두더지로 표현되는 문제 유형에 초점을 맞출 것입니다.

화학 방정식은 반응물과 생성물의 양을 나타냅니다. 반응의 반응물과 생성물. 균형 방정식의 계수는 각 물질의 분자 수 또는 몰 수를 나타낼 수 있습니다. 질소와 수소 가스에서 암모니아 \ (\ left (\ ce {NH_3} \ right) \)를 생산하는 것은 독일 화학자 Fritz Haber의 뒤를 이은 Haber 공정이라는 중요한 산업 반응입니다.
\
균형 방정식은 아래 그림과 같이 여러 가지 방법으로 분석 할 수 있습니다.
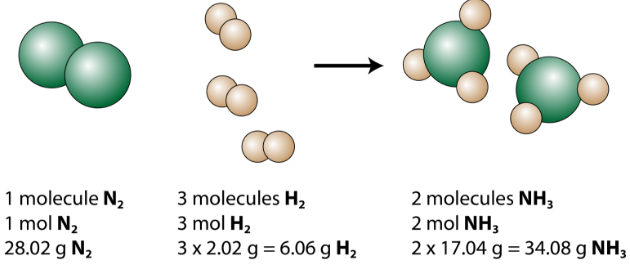
우리는 질소 1 분자가 수소 3 분자와 반응하여 2 분자의 암모니아를 형성합니다. 이것은 반응물과 생성물의 가능한 가장 적은 상대적인 양입니다. 더 큰 상대적인 양을 고려하기 위해 각 계수에 동일한 숫자를 곱할 수 있습니다. 예를 들어, 10 개의 질소 분자는 30 개의 수소 분자와 반응하여 20 개의 암모니아 분자를 생성합니다.
입자를 계산하는 데 가장 유용한 양은 몰입니다. 따라서 각 계수에 1 몰을 곱하면 균형 잡힌 화학 방정식은 1 몰의 질소가 3 몰의 수소와 반응하여 2 몰의 암모니아를 생성한다는 것을 알려줍니다. 이것은 균형 잡힌 화학 방정식을 해석하는 일반적인 방법입니다.
\
화학 반응에서 질량과 원자 수는 보존되어야합니다. 분자 수가 반드시 보존되는 것은 아닙니다.

몰 비율은 화학 반응에서 두 물질의 몰수를 나타내는 변환 계수입니다. 변환 계수의 숫자는 균형 화학 방정식의 계수에서 나옵니다. 위의 암모니아 형성 반응에 대해 다음 6 개의 몰비를 쓸 수 있습니다.
몰비 문제에서는 몰로 표현 된 주어진 물질이 먼저 쓰여집니다. 주어진 물질의 몰에서 미지의 몰로 변환하기 위해 적절한 변환 계수가 선택됩니다.