인간 신경 과학의 경계
소개
의식은 환경과 자아에 대한 각성과 자각이며, 이는 상승하는 망상 활성화 시스템 (ARAS)의 작용을 통해 달성됩니다. 뇌간과 대뇌 피질 (Daube, 1986; Paus, 2000; Zeman, 2001; Gosseries et al., 2011). ARAS는 뇌간을 피질에 연결하는 여러 신경 회로로 구성됩니다. 이러한 뉴런 연결은 주로 뇌간의 망상 형성 (RF)에서 시작되며 시상 내핵에서 대뇌 피질로의 시냅스 릴레이를 통해 투영됩니다 (Daube, 1986; Paus, 2000; Zeman, 2001; Afifi and Bergman, 2005; Gosseries et al., 2011). 또한 ARAS 시스템에는 여러 뇌간 핵 (장핵, 등쪽 등줄, 중앙 등줄, 페 둔쿨로 폰틴 핵, 상완 주위 핵), 비특이적 시상 핵, 시상 하부 및 기저 전뇌도 포함됩니다 (Aston-Jones et al., 2001 ; Parvizi and Damasio, 2003; Fuller et al., 2011). ARAS에 대한 철저한 평가는 식물 상태에있는 환자 나 최소한의 의식을 가진 환자와 같이 의식이 손상된 환자의 진단 및 관리에 중요합니다 (Zeman, 2001; Gosseries et al., 2011).
기존의 뇌 MRI, 기능적 신경 영상 기법, 전기 생리 학적 방법 및 MR 분광기는 인간 뇌의 ARAS 연구에 사용되었습니다 (Parvizi and Damasio, 2003; Schiff, 2006; Tshibanda et al., 2009, 2010; Gawryluk et al ., 2010). 그러나 ARAS는 인접한 신경 구조와 명확하게 구별 할 수 없기 때문에 이러한 방법을 사용할 때 인간의 뇌에서 ARAS의 정확한 식별 및 추정이 문제가 될 수 있습니다. 대조적으로, DTI (확산 텐서 이미징)는 물 확산 특성을 이미지화 할 수있는 능력 때문에 백질을 평가할 수 있습니다 (Mori et al., 1999). 정상적인 백질에서 물 분자는 신경 섬유 관과 평행하게 상대적으로 자유롭게 움직입니다. 그러나 이들의 움직임은 여러 구역에 걸쳐 제한되어 백색 물질의 확산 이방성을 유발합니다. 따라서 백색질의 섬유 변화 정도를 평가하기 위해 확산 이방성이 사용되었다 (Chang et al., 2010; Puig et al., 2010). 최근의 여러 연구에서 인간 뇌에서 특정 ARAS 핵의 연결성 및 의식 장애 환자의 병변 평가에 DTI의 유용성을 입증하려고 시도했습니다 (Voss et al., 2006; Perlbarg et al., 2009; Tollard et al., 2009; Tshibanda et al., 2009; Fernandez-Espejo et al., 2010, 2011; Newcombe et al., 2010; Edlow et al., 2012). 그러나 인간 뇌에서 ARAS의 전체 재구성 및 추정에 대해서는 알려진 바가 거의 없습니다 (Edlow et al., 2012).
현재 연구에서는 DTI를 사용하여 하위 단일 구성 요소를 재구성하려고했습니다. 교두 RF에서 정상 인간 뇌의 시상 내핵까지의 ARAS.
재료 및 방법
대상
26 명의 정상 건강한 대상 (남성 14 명, 여성 12 명, 평균 연령, 31.85 ± 9.80 세, 범위, 20-50 세) 신경계 질환의 병력이없는 사람이이 연구를 위해 모집되었습니다. 모든 피험자는이 연구에 자원자로 참여했으며 DTI 스캔을 받기 전에 서면 동의를 제공했습니다. 이 연구는 우리 병원의 기관 검토위원회의 승인을 받았습니다.
확산 텐서 이미지
DTI 데이터는 1.5-T Philips Gyroscan Intera에서 6 채널 헤드 코일을 사용하여 수집되었습니다. Philips, Best, Netherlands)의 단일 샷 에코 평면 이미징. 32 개의 비 동일 선형 확산 민감화 기울기 각각에 대해 전방 교합-후방 교합 선에 평행 한 67 개의 연속 슬라이스를 획득했습니다. 이미징 매개 변수는 다음과 같습니다. 획득 매트릭스 = 96 × 96, 매트릭스로 재구성 됨 = 128 × 128, 시야 = 221mm × 221mm, TR = 10,726ms, TE = 76ms, 병렬 이미징 감소 계수 (SENSE 계수) = 2, EPI 계수 = 49, b = 1000s / mm2, NEX = 1, 슬라이스 두께 2.3mm (획득 된 등방성 복셀 크기 2.3mm × 2.3mm × 2.3mm)
확률 적 섬유 추적
확산 가중치 영상 데이터의 분석은 Oxford Center for Functional Magnetic Resonance Imaging of the Brain (FMRIB) 소프트웨어 라이브러리 (FSL; www.fmrib.ox.ac.uk/fsl)를 사용하여 수행되었습니다. 머리 움직임 효과와 와전류로 인한 이미지 왜곡을 보정하기 위해 Affine 다중 스케일 2 차원 정합이 사용되었습니다. 섬유 추적은 다중 섬유 모델을 기반으로 한 확률 적 tractography 방법을 사용하여 수행되었으며 FMRIB Diffusion에서 구현 된 tractography 루틴을 사용하여 현재 연구에 적용되었습니다 (5000 개의 유선형 샘플, 0.5mm 단계 길이, 곡률 임계 값 = 0.2) (Smith et al., 2004 ).이 연구에 사용 된 확률 적 tractography의 장점은 소음에 대한 더 큰 견고 함과 더 날카로운 각도로 경로를 감지하고 교차하는 섬유를 구별하는 능력을 포함합니다 (Behrens et al., 2007; Winston et al., 2011).
ARAS의 경로는 관심 종자 영역 (ROI) 및 표적 (종료) ROI를 통과하는 섬유의 선택에 의해 결정되었습니다. 종자 ROI는 삼차 신경 진입 영역 수준에서 폰의 RF에 배치되었습니다 (Daube, 1986; Afifi and Bergman, 2005). 내측 lemniscus 및 rubrospinal tract의 분석은 pons의 RF 경계를 확인하기 위해 수행되었습니다 (그림 1A). 내측 lemniscus의 분석을 위해 종자 ROI를 전 내측 수질에 배치하고 목표 ROI를 체성 감각 피질에 배치했습니다 (Hong et al., 2010). rubrospinal tract 분석을 위해 종자 ROI를 적색 핵에 배치하고 목표 ROI를 수질의 대측 배측 영역 (Monakow 영역)에 배치했습니다 (Nathan and Smith, 1982; Kwon et al., 2011). 목표 ROI는 연결면 수준에서 시상의 내부 핵에 주어졌습니다 (Morel, 2007). 시상의 intralaminar 핵을 정의 할 때 우리는 뇌 아틀라스를 참조했습니다 (Morel, 2007) (그림 1A). 시드 복셀에서 생성 된 5000 개의 샘플 중 접촉에 대한 결과는 분석을 위해 각 복셀을 통해 간소화 된 최소 임계 값 1에서 시각화되었습니다. 분수 이방성 (FA), 평균 확산도 (MD), ARAS 하부 단일 성분의 관로 값을 측정했습니다.
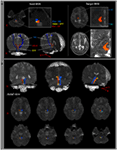
그림 1. (A) 관심 종자 영역 (ROI)은 교두 망상 형성 (빨간색)에 제공됩니다. 목표 ROI는 연결 평면 수준에서 시상의 내부 핵에 제공됩니다. 시상의 내부 핵의 경계는 뇌지도 책의 교과서 (Morel, 2007)를 참조하여 정의되었습니다. ML, 내측 lemniscus; RST, rubrospinal tract; RF, 망상 형성; AC, 전방 교합; PC, 후방 교합. (B) 정상 대상 (26 세 남성)의 뇌의 각 수준에서 재구성 된 상승 망상 활성화 시스템의 경로가 표시됩니다.
통계 분석
SPSS 소프트웨어 (v.15.0; SPSS, 미국 일리노이 주 시카고)가 데이터 분석에 사용되었습니다. Paired t-test는 오른쪽과 왼쪽 반구 사이의 ARAS의 DTI 매개 변수 값의 차이를 결정하는 데 사용되었습니다. ARAS의 DTI 매개 변수와 연령 간의 상관 관계를 결정하기 위해 Pearson 상관 관계 테스트를 사용했습니다. p 값이 < 0.05 일 때 결과가 중요한 것으로 간주되었습니다.
결과
우리는 폰틴 사이에 ARAS의 하위 단일 구성 요소를 재구성했습니다. 시상의 RF 및 intralaminar 핵. ARAS의 재구성 된 구성 요소는 pontine RF에서 시작되었으며, 적색 핵 바로 뒤에있는 중뇌 tegmentum을 통해 상승한 다음 모든 피험자에서 commissural plane의 수준에서 시상의 intralaminar 핵에서 종료되었습니다 (그림 1B). / p>
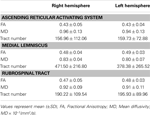
표 1. 상승하는 망상 형 활성화 시스템의 확산 텐서 이미징 매개 변수 .
토론
현재 연구에서는 DTI를 사용하여 주요 경로 중 하나를 재구성했습니다. ARAS는 정상적인 피험자에서 RF에서 시상까지 ARAS의 하위 단일 구성 요소이지만 ARAS는 추가 뇌간 핵, 시상 하부, 기저 전뇌 및 대뇌 피질에 대한 시상 세포 투영으로 구성됩니다. 우리는 ARAS의 하부 단일 구성 요소의 재구성을 위해 두 개의 ROI를 선택했습니다. 삼차 신경 진입 영역 수준에서 폰의 RF 인 시드 ROI (Daube, 1986; Afifi and Bergman, 2005)와 타겟 ROI는 시상의 내부 핵 (중앙 측면 핵, centromedian / parafascicular nuclei 및 paracentral nuclei)을 commissural plane 수준에서 포함합니다 (Morel, 2007). 삼차 신경 진입 영역 위에있는 뇌간 RF의 주둥이 부분을 ARAS라고합니다. 반대로 RF의 꼬리 부분은 심장 및 호흡 기능과 관련된 운동 기능 및 자율 기능에 관여합니다 (Daube, 1986). 따라서 우리는 삼차 신경 진입 영역 수준의 RF에 종자 ROI를 배치했습니다. 비특이적 시상 핵 중 ARAS의 주요 핵인 intralaminar 핵에 타겟 ROI를 배치했습니다. 따라서 우리는 ARAS와 관련된 다른 시상 핵을 포함 할 수 없기 때문에 현재 연구에서 재구성 된 ARAS의 하위 단일 구성 요소가 ARAS의 전체 하위 단일 구성 요소가 아니라 주요 부분이라고 생각합니다. ARAS의 전체 하위 단일 구성 요소.결과적으로, ARAS의 하부 단일 구성 요소는 교두 RF에서 유래하여 적색 핵의 뒤쪽 중뇌 tegmentum을 통해 상승한 다음 시상의 내부 핵에서 종결됩니다. 또한, ARAS의 재구성 된 하부 단일 구성 요소의 FA, MD 및 tract 번호에 대한 값은 오른쪽과 왼쪽 반구 사이에서 크게 다르지 않았습니다. 관 수는 신경관 내에 포함 된 복셀의 수에 의해 결정됩니다 (Kwak et al., 2010). FA 값은 axons, myelin, microtubules와 같은 백질 미세 구조의 방향성과 무결성의 정도를 나타내고 ADC 값은 물 확산의 크기를 나타냅니다 (Assaf and Pasternak, 2008).
여러 연구 의식이 손상된 환자에서 RF에서 시상까지 ARAS의 하부 단일 성분의 일부 영역을 추정하여 DTI의 임상 적 유용성을 입증했습니다 (Perlbarg et al., 2009; Tollard et al., 2009; Newcombe et al., 2010; Fernandez-Espejo et al., 2011). Tollard et al. (2009)는 중증 TBI (외상성 뇌 손상) 환자 45 명의 결과 예측을 위해 아 급성 단계에서 수행 된 DTI의 유용성을보고했습니다 (단순 주문에 대한 반응 없음). 그들의 연구에서 그들은 전방 폰, 후방 폰, 중뇌를 포함하는 여러 상하부 및 하 뇌부에서 FA 값을 측정했으며, 후부를 제외한 하반부 및 상하부 FA의 감소가 바람직하지 않은 결과를 예측할 수 있음을 입증했습니다. TBI에서 1 년. Perlbarg et al. (2009), 중증 TBI 후 단순 주문에 대한 반응이없는 30 명의 환자를 대상으로 DTI 스캔을 수행 한 바에 따르면, 하종 근막, 중뇌 (대뇌 꽃자루 및 tegmentum), 내부 캡슐의 후방 사지에서 측정 된 FA의 명확한 감소를보고했습니다. , 그리고 불리한 결과 그룹에서 후방 뇌량. Newcombe et al. (2010)은 TBI에 이차적 인 식물 상태에있는 환자 (7 명의 환자)와 허혈성 저산소 손상 환자 (5 명의 환자)에서 백질 손실의 정도와 위치를 특성화하기 위해 DTI를 사용했습니다. 두 그룹 모두에서 supratentorial 영역의 이상이 관찰되었습니다. 대조적으로 뇌간의 이상은 TBI 그룹에서만 관찰되었다. Fernandez-Espejo et al. (2011)은 25 명의 영양 및 최소 의식 환자의 신경 병리를 분화하는데 DTI를 사용했습니다. 그들은 최소한의 의식을 가진 환자와 식물 상태에있는 환자는 피질 하 백질과 시상 영역에서 다르지만 뇌간에서는 다르지 않은 것으로 결론지었습니다. 높은 각도 해상도 확산 이미징을 사용한 최근 연구에서 Edlow et al. (2012)는 생체 내 및 생체 외에서 인간 뇌에서 ARAS의 신경 해부학 적 연결에 대해보고했습니다. 그들은 특정 ARAS 핵의 연결성이 각성에 연루되고 시상 핵의 연결이 각성의 조절에 연루된다는 것을 입증했습니다.
결론적으로 DTI를 사용하여 우리는 ARAS의 하위 단일 구성 요소를 재구성했습니다. 인간 뇌의 시상 RF. 우리는 사용 된 방법론과이 연구의 결과가 인간 뇌에서 ARAS를 연구하는 연구자들에게 도움이 될 것이라고 믿습니다. 그러나이 연구의 한계 중 하나는 ARAS와 관련된 다른 시상 및 뇌간 핵을 분석에 포함하지 않았기 때문에 전체 ARAS 시스템을 완전히 설명 할 수 없다는 것입니다. 우리 발견의 임상 적 유용성에 대한 추가 연구와 시상에서 대뇌 피질로의 ARAS 투영에 대한 연구가 필요합니다.
이해 상충 진술
저자는 선언합니다. 이 연구는 잠재적 인 이해 상충으로 간주 될 수있는 상업적 또는 재정적 관계가없는 상태에서 수행되었습니다.
감사 사항
이 작업은 DGIST R
교육 과학 기술부 D 프로그램 (13-BD-0401).
Afifi, AK 및 Bergman, RA (2005). 기능성 신경 해부학 : 텍스트 및 아틀라스. 뉴욕 : Lange Medical Books / McGraw-Hill.
Morel, A. (2007). 인간 시상 및 기저핵의 정위 아틀라스. 뉴욕 : Informa Healthcare.