12.2:モル比
モル比
化学量論の問題は、次の2つの特徴があります。(1)問題で与えられた情報。 (2)未知と呼ばれる、解決される情報。与えられたものと未知のものは両方とも反応物であるか、両方とも生成物であるか、または一方が反応物であり、他方が生成物である可能性があります。物質の量はモルで表すことができます。ただし、実験室の状況では、物質の質量をグラムで見つけることによって物質の量を決定するのが一般的です。気体物質の量は、その体積で表すことができます。この概念では、与えられた量と未知の量の両方がモルで表される問題のタイプに焦点を当てます。

化学反応式は、反応物と生成物の量を表します。反応中の反応物と生成物。平衡方程式の係数は、各物質の分子数またはモル数のいずれかを表すことができます。窒素ガスと水素ガスからのアンモニア\(\ left(\ ce {NH_3} \ right)\)の生成は、ドイツの化学者フリッツハーバーにちなんで、ハーバープロセスと呼ばれる重要な工業反応です。
\
次の図に示すように、平衡方程式はいくつかの方法で分析できます。
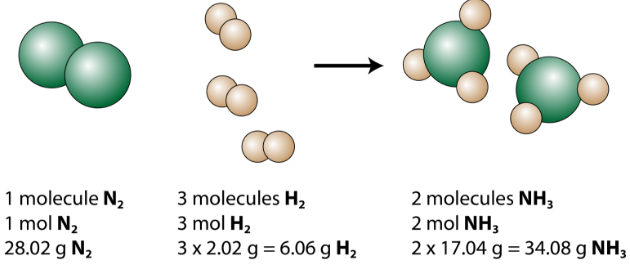
1分子の窒素が3分子の水素と反応して2分子のアンモニアを形成することがわかります。これは、反応物と生成物の可能な限り最小の相対量です。より大きな相対量を考慮するために、各係数に同じ数を掛けることができます。たとえば、10分子の窒素が30分子の水素と反応して、20分子のアンモニアを生成します。
粒子を数えるのに最も有用な量はモルです。したがって、各係数に1モルを掛けると、平衡化学反応式から、1モルの窒素が3モルの水素と反応して、2モルのアンモニアが生成されることがわかります。これは、バランスの取れた化学反応式を解釈する従来の方法です。
\
化学反応では、質量と原子数を保存する必要があります。分子の数は必ずしも保存されているわけではありません。

モル比は、化学反応における任意の2つの物質のモル数に関連する換算係数です。換算係数の数値は、平衡化学反応式の係数に基づいています。上記のアンモニア生成反応について、次の6つのモル比を記述できます。
モル比の問題では、モルで表された特定の物質が最初に記述されます。与えられた物質のモルから未知のモルに変換するために、適切な変換係数が選択されます。