人間の神経科学の最前線
はじめに
意識は、環境と自己の覚醒と認識であり、上行網様体活性化システム(ARAS)の作用によって達成されます。脳幹と大脳皮質(Daube、1986; Paus、2000; Zeman、2001; Gosseries et al。、2011)。 ARASは、脳幹と皮質を接続するいくつかの神経回路で構成されています。これらのニューロンの接続は、主に脳幹の網様体(RF)で発生し、視床の層内核のシナプスリレーを介して大脳皮質に投射します(Daube、1986; Paus、2000; Zeman、2001; Afifi and Bergman、2005; Gosseries et al。、2011)。さらに、いくつかの脳幹核(青斑核、背側レイプ、正中レイプ、脚橋被蓋核、傍小脳脚核)、非特異的視床核、視床下部、および前脳基底部もARASシステムに含まれています(Aston-Jones et al。、2001 ; Parvizi and Damasio、2003; Fuller et al。、2011)。 ARASの徹底的な評価は、遷延性意識障害の患者や最小限の意識の患者など、意識障害のある患者の診断と管理にとって重要です(Zeman、2001; Gosseries et al。、2011)。
従来の脳MRI、脳機能イメージング技術、電気生理学的方法、およびMRスペクトロスコピーは、人間の脳のARASの研究に使用されてきました(Parvizi and Damasio、2003; Schiff、2006; Tshibanda et al。、2009、2010; Gawryluk et al。 。、2010)。ただし、ARASは隣接する神経構造から明確に区別できないため、これらの方法を使用する場合、人間の脳内のARASの正確な識別と推定が問題になる可能性があります。対照的に、拡散テンソル画像(DTI)は、水の拡散特性を画像化する能力があるため、白質の評価を可能にします(Mori et al。、1999)。通常の白質では、水分子は神経線維路と平行に比較的自由に動くことができます。しかし、それらの動きは管を越えて制限されており、白質の拡散異方性を引き起こします。したがって、拡散異方性は、白質の繊維変化の程度の評価に使用されてきました(Chang et al。、2010; Puig et al。、2010)。いくつかの最近の研究は、人間の脳の特定のARAS核の意識と接続性が損なわれた患者の病変の評価に対するDTIの有用性を実証しようと試みました(Voss et al。、2006; Perlbarg et al。、2009; Tollard et al。、 2009; Tshibanda et al。、2009; Fernandez-Espejo et al。、2010、2011; Newcombe et al。、2010; Edlow et al。、2012)。しかし、人間の脳におけるARASの全体的な再構築と推定についてはほとんど知られていません(Edlow et al。、2012)。
現在の研究では、DTIを使用して、下部の単一成分の再構築を試みました。橋RFから正常な人間の脳の視床の層内核へのARASの変化。
材料と方法
被験者
26人の正常な健康な被験者(男性14人、女性12人、平均年齢31.85±9.80歳、範囲20〜50歳)、神経疾患の病歴のない人をこの研究に採用しました。すべての被験者はボランティアとしてこの研究に参加し、DTIスキャンを受ける前に書面による同意を提供しました。この研究は、当院の施設内審査委員会によって承認されました。
拡散テンソル画像
DTIデータは、1.5-Tフィリップスジャイロスキャンインターラの6チャンネルヘッドコイルを使用して取得されました(フィリップス、ベスト、オランダ)シングルショットエコープラナーイメージング。 32の非共線拡散増感勾配のそれぞれについて、前交連-後交連線に平行な67の連続したスライスを取得しました。イメージングパラメータは次のとおりです。取得マトリックス= 96×96、マトリックス= 128×128に再構成、視野= 221mm×221mm、TR = 10,726 ms、TE = 76 ms、並列イメージング低減係数(SENSE係数)= 2、EPI係数= 49、b = 1000 s / mm2、NEX = 1、スライス厚2.3 mm(取得した等方性ボクセルサイズ2.3mm×2.3mm×2.3mm)。
確率的ファイバー追跡
拡散強調画像データの分析は、脳の機能的磁気共鳴画像法のためのオックスフォードセンター(FMRIB)ソフトウェアライブラリ(FSL; www.fmrib.ox.ac.uk/fsl)を使用して実行されました。アフィンマルチスケール二次元レジストレーションは、渦電流による頭の動きの影響と画像の歪みの補正に使用されました。ファイバートラッキングは、マルチファイバーモデルに基づく確率的トラクトグラフィー法を使用して実行され、FMRIB拡散で実装されたトラクトグラフィールーチン(5000流線サンプル、0.5 mmステップ長、曲率しきい値= 0.2)を利用した現在の研究に適用されました(Smith et al。、2004 )。この研究で使用された確率的トラクトグラフィーの利点には、ノイズに対するより優れた堅牢性、およびより鋭い角度で経路を検出し、交差するファイバーを区別する機能が含まれます(Behrens et al。、2007; Winston et al。、2011)。
ARASの経路は、シード領域(ROI)とターゲット(終端)ROIを通過するファイバーを選択することによって決定されました。シードROIは、三叉神経侵入ゾーンのレベルで橋のRFに配置されました(Daube、1986; Afifi and Bergman、2005)。橋のRFの境界を確認するために、内側毛帯と赤核脊髄路の分析を行いました(図1A)。内側毛帯の分析のために、シードROIを前内側延髄に配置し、ターゲットROIを体性感覚皮質に配置しました(Hong et al。、2010)。赤核脊髄路の分析のために、シードROIを赤核に配置し、ターゲットROIを延髄の反対側背外側領域(モナコウ領域)に配置しました(Nathan and Smith、1982; Kwon et al。、2011)。目標ROIは、交連面のレベルで視床の層内核に与えられました(Morel、2007)。視床の層内核を定義する際に、脳地図を参照しました(Morel、2007)(図1A)。シードボクセルから生成された5000個のサンプルのうち、接触の結果は、分析のために各ボクセルを介して合理化された最小しきい値1で視覚化されました。部分異方性(FA)、平均拡散係数(MD)、およびARASの下部単一成分の管数の値を測定しました。
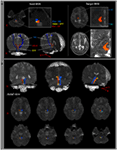
図1.(A)関心のあるシード領域(ROI)は、橋の網状構造(赤色)に示されています。目標ROIは、交連面のレベルで視床の層内核に与えられます。視床の層内核の境界は、脳地図の教科書を参照して定義されました(Morel、2007)。 ML、内側毛帯; RST、赤核脊髄路; RF、網様体; AC、前交連; PC、後交連。 (B)再構築された上行網様体活性化システムの経路は、正常な被験者(26歳の男性)の脳の各レベルで示されています。
統計分析
SPSSソフトウェア(v.15.0; SPSS、シカゴ、イリノイ、米国)をデータ分析に使用しました。対応のあるt検定を使用して、右半球と左半球の間のARASのDTIパラメーターの値の差を決定しました。ピアソン相関テストは、ARASのDTIパラメーターと年齢の間の相関を決定するために使用されました。 p値が< 0.05の場合、結果は有意であると見なされました。
結果
橋の間のARASの下部単一成分を再構築しました。視床のRFおよび層内核。 ARASの再構築されたコンポーネントは、橋RFから始まり、赤核のすぐ後ろの中脳幹を通って上昇し、その後、すべての被験者の視床の層内核で交連面のレベルで終了しました(図1B)。
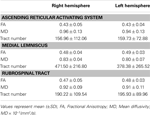
表1.上行網様体活性化システムの拡散テンソルイメージングパラメーター。
ディスカッション
現在の研究では、DTIを使用して、次の主要な経路の1つを再構築しました。 ARASは、正常な被験者のRFから視床までのARASの下部単一成分ですが、ARASは、追加の脳幹核、視床下部、基底前脳、および大脳皮質への視床皮質投射で構成されています。 ARASの下部単一コンポーネントの再構築のために2つのROIを選択しました。三叉神経侵入ゾーンのレベルでの橋のRFであるシードROI(Daube、1986; Afifi and Bergman、2005)とターゲットです。交連面のレベルでの視床の層内核(中央外側核、セントロメディアン/傍束核、および傍中心核)を含むROI(Morel、2007年)。三叉神経侵入ゾーンの上の脳幹のRFの吻側部分は、ARASとして知られています。対照的に、RFの尾側部分は、心臓および呼吸機能に関連する運動機能および自律神経機能に関与しています(Daube、1986)。したがって、シードROIを三叉神経侵入ゾーンのレベルでRFに配置しました。非特異的な視床核の中でARASの主要な核である層内核にターゲットROIを配置しました。したがって、ARASに関係する他の視床核を含めることができなかったため、現在の研究で再構築されたARASの下部単一成分は、ARASの下部単一成分全体ではなく、 ARASの下部単一コンポーネント全体。その結果、ARASの下部単一成分は、橋RFに由来し、赤核の後方の中脳被蓋を通って上昇し、視床の層内核で終結しました。さらに、ARASの再構築された下部単一コンポーネントのFA、MD、および管番号の値は、右半球と左半球の間で有意差はありませんでした。管数は、神経管内に含まれるボクセルの数によって決定されます(Kwak et al。、2010)。 FA値は、軸索、ミエリン、微小管などの白質微細構造の方向性と完全性の程度を示し、ADC値は、水の拡散の大きさを示します(Assaf and Pasternak、2008)。
いくつかの研究意識障害のある患者のRFから視床までのARASの下部単一成分のいくつかの領域を推定することにより、DTIの臨床的有用性を実証しました(Perlbarg et al。、2009; Tollard et al。、2009; Newcombe et al。、 2010; Fernandez-Espejo et al。、2011)。 Tollard etal。 (2009)重度のTBI(外傷性脳損傷)(単純な命令への反応の欠如)を持つ45人の患者の結果の予測のために亜急性段階で実行されたDTIの有用性について報告しました。彼らの研究では、前橋、後橋、中脳を含むいくつかのテント上およびテント下領域でFA値を測定し、後橋を除いてテント下およびテント上FAの減少により、好ましくない結果の予測が可能になることを示しました。 TBIから1年。 Perlbarg etal。 (2009)重度のTBIに続く単純な命令への応答のない30人の患者でDTIスキャンを実行した、下縦束、中脳(大脳脚と被蓋)、内包の後肢で測定されたFAの明確な減少を報告しました、および不利な結果グループにおける後部脳梁。 Newcombe etal。 (2010)TBIに続発する植物状態にあった患者(7人の患者)と虚血性低酸素傷害の患者(5人の患者)における白質喪失の程度と場所の特徴づけのためにDTIを使用しました。テント上領域の異常は両方のグループで観察されました。対照的に、脳幹の異常はTBIグループでのみ観察されました。 Fernandez-Espejo etal。 (2011)25人の栄養のあるそして最小限に意識のある患者の神経病理学の分化においてDTIを使用しました。彼らは、意識の低い患者と遷延性意識障害の患者は、皮質下白質と視床領域で異なっていたが、脳幹では異なっていないように見えたと結論付けた。高角度分解能拡散イメージングを使用した最近の研究では、Edlow etal。 (2012)invivoとexvivoの両方で、人間の脳におけるARASの神経解剖学的接続性について報告しました。彼らは、特定のARAS核の接続性が覚醒に関与し、視床核の接続性が覚醒の調節に関与していることを示しました。
結論として、DTIを使用して、ARASの下部単一成分を人間の脳の視床へのRF。使用された方法論とこの研究の結果は、人間の脳でARASを研究する研究者に役立つかもしれないと信じています。しかし、この研究の限界の1つは、ARASに関与している他の視床および脳幹核を分析に含めなかったため、ARASシステム全体を完全に解明できなかったことです。私たちの発見の臨床的有用性に関するさらなる研究、および視床から大脳皮質へのARASの予測に関する研究が必要です。
利益相反声明
著者は宣言します潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない状態で調査が実施されたこと。
謝辞
この研究は、DGIST R
韓国教育科学技術省のDプログラム(13-BD-0401)。
Afifi、AK、およびBergman、RA(2005)。機能的神経解剖学:テキストとアトラス。ニューヨーク:Lange Medical Books / McGraw-Hill。
Morel、A。(2007)人間の視床と大脳基底核の定位アトラス。ニューヨーク:InformaHealthcare。