Frontiers in Human Neuroscience (Italiano)
Introduzione
La coscienza è uneccitazione e consapevolezza dellambiente e del sé, che si ottiene attraverso lazione del sistema di attivazione reticolare ascendente (ARAS) su il tronco encefalico e la corteccia cerebrale (Daube, 1986; Paus, 2000; Zeman, 2001; Gosseries et al., 2011). LARAS è composto da diversi circuiti neuronali che collegano il tronco cerebrale alla corteccia. Queste connessioni neuronali hanno origine principalmente nella formazione reticolare (RF) del tronco cerebrale e si proiettano attraverso i relè sinaptici nel nucleo intralaminare del talamo alla corteccia cerebrale (Daube, 1986; Paus, 2000; Zeman, 2001; Afifi e Bergman, 2005; Gosseries et al., 2011). Inoltre, nel sistema ARAS sono inclusi anche diversi nuclei del tronco cerebrale (locus coeruleus, raphe dorsale, raphe mediano, nucleo pedunculopontino, nucleo parabrachiale), nuclei talamici aspecifici, ipotalamo e proencefalo basale (Aston-Jones et al., 2001 ; Parvizi e Damasio, 2003; Fuller et al., 2011). La valutazione approfondita dellARAS è importante per la diagnosi e la gestione dei pazienti con ridotta coscienza, come i pazienti che sono in uno stato vegetativo o quelli con una coscienza minima (Zeman, 2001; Gosseries et al., 2011).
La risonanza magnetica cerebrale convenzionale, le tecniche di neuroimaging funzionale, i metodi elettrofisiologici e la spettroscopia MR sono stati utilizzati negli studi sullARAS nel cervello umano (Parvizi e Damasio, 2003; Schiff, 2006; Tshibanda et al., 2009, 2010; Gawryluk et al. ., 2010). Tuttavia, poiché lARAS non può essere chiaramente discriminato dalle strutture neurali adiacenti, lidentificazione e la stima accurate dellARAS nel cervello umano possono essere problematiche quando si utilizzano questi metodi. Al contrario, limaging del tensore di diffusione (DTI) consente la valutazione della materia bianca grazie alla sua capacità di visualizzare le caratteristiche di diffusione dellacqua (Mori et al., 1999). Nella sostanza bianca normale, le molecole dacqua hanno una relativa libertà di movimento parallela ai tratti delle fibre nervose. Tuttavia, i loro movimenti sono limitati attraverso i tratti, dando origine allanisotropia di diffusione della sostanza bianca. Di conseguenza, lanisotropia di diffusione è stata utilizzata per valutare lentità della variazione delle fibre nella sostanza bianca (Chang et al., 2010; Puig et al., 2010). Diversi studi recenti hanno tentato di dimostrare lutilità della DTI per la valutazione delle lesioni in pazienti con ridotta coscienza e connettività di specifici nuclei ARAS nel cervello umano (Voss et al., 2006; Perlbarg et al., 2009; Tollard et al., 2009; Tshibanda et al., 2009; Fernandez-Espejo et al., 2010, 2011; Newcombe et al., 2010; Edlow et al., 2012). Tuttavia, si sa poco dellintera ricostruzione e stima dellARAS nel cervello umano (Edlow et al., 2012).
Nello studio attuale, utilizzando DTI, abbiamo tentato di ricostruire il singolo componente inferiore dellARAS dalla RF pontina ai nuclei intralaminari del talamo nel cervello umano normale.
Materiali e metodi
Soggetti
Ventisei soggetti sani normali (14 maschi, 12 femmine; età media, 31,85 ± 9,80 anni; intervallo, 20-50) senza storia di malattia neurologica sono stati reclutati per questo studio. Tutti i soggetti hanno partecipato a questo studio come volontari e hanno fornito il consenso scritto prima di sottoporsi alla scansione DTI. Lo studio è stato approvato dal comitato di revisione istituzionale del nostro ospedale.
Immagine del tensore di diffusione
I dati DTI sono stati acquisiti utilizzando una bobina a 6 canali su un Philips Gyroscan Intera da 1,5 T ( Philips, Best, Paesi Bassi) con imaging eco-planare a scatto singolo. Per ciascuno dei 32 gradienti di sensibilizzazione alla diffusione non collineari, abbiamo acquisito 67 sezioni contigue parallele alla linea della commissura anteriore-posteriore. I parametri di imaging erano i seguenti: matrice di acquisizione = 96 × 96, ricostruita in matrice = 128 × 128, campo visivo = 221 mm × 221 mm, TR = 10.726 ms, TE = 76 ms, fattore di riduzione dellimaging parallelo (fattore SENSE) = 2, fattore EPI = 49 eb = 1000 s / mm2, NEX = 1 e uno spessore di fetta di 2,3 mm (dimensione voxel isotropica acquisita 2,3 mm × 2,3 mm × 2,3 mm).
Fibra probabilistica Tracciamento
Lanalisi dei dati di imaging pesati in diffusione è stata eseguita utilizzando la libreria software (FSL; www.fmrib.ox.ac.uk/fsl) dellOxford Center for Functional Magnetic Resonance Imaging of the Brain (FMRIB). La registrazione bidimensionale multiscala affine è stata utilizzata per la correzione delleffetto di movimento della testa e della distorsione dellimmagine dovuta alle correnti parassite. Il tracciamento delle fibre è stato eseguito utilizzando un metodo di trattografia probabilistico basato su un modello multifibra e applicato nello studio corrente utilizzando routine di trattografia implementate in FMRIB Diffusion (5000 campioni streamline, lunghezze di passo di 0,5 mm, soglie di curvatura = 0,2) (Smith et al., 2004 ).I vantaggi della trattografia probabilistica, che è stata utilizzata in questo studio, includono una maggiore robustezza al rumore, nonché la capacità di rilevare percorsi con angoli più acuti e di distinguere le fibre incrociate (Behrens et al., 2007; Winston et al., 2011).
Il percorso dellARAS è stato determinato dalla selezione di fibre che passano attraverso le regioni di interesse (ROI) seme e le ROI target (terminazione). Un ROI seme è stato posto sulla RF del ponte a livello della zona di ingresso del nervo trigemino (Daube, 1986; Afifi e Bergman, 2005). È stata eseguita lanalisi del lemnisco mediale e del tratto rubrospinale per confermare il confine della RF sul ponte (Figura 1A). Per lanalisi del lemnisco mediale, le ROI dei semi sono state posizionate sul midollo anteromediale e la ROI target è stata posizionata sulla corteccia somatosensoriale (Hong et al., 2010). Per lanalisi del tratto rubrospinale, le ROI dei semi sono state posizionate sul nucleo rosso e la ROI target è stata posizionata sulla regione dorsolaterale controlaterale del midollo (area di Monakow) (Nathan e Smith, 1982; Kwon et al., 2011). Il ROI target è stato fornito sui nuclei intralaminari del talamo a livello del piano commissurale (Morel, 2007). Nella definizione dei nuclei intralaminari del talamo, abbiamo fatto riferimento a un atlante del cervello (Morel, 2007) (Figura 1A). Di 5000 campioni generati dal voxel seme, i risultati per il contatto sono stati visualizzati a una soglia minima di 1 semplificata attraverso ciascun voxel per lanalisi. Sono stati misurati i valori di anisotropia frazionaria (FA), diffusività media (MD) e numero di tratti del singolo componente inferiore di ARAS.
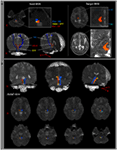
Figura 1. (A) Le regioni di interesse (ROI) del seme sono fornite sulla formazione reticolare pontina (colore rosso). Il ROI target è dato sui nuclei intralaminari del talamo a livello del piano commissurale. Il confine dei nuclei intralaminari del talamo è stato definito facendo riferimento al libro di testo dellatlante del cervello (Morel, 2007). ML, lemnisco mediale; RST, tratto rubrospinale; RF, formazione reticolare; AC, commessura anteriore; PC, commessura posteriore. (B) I percorsi del sistema di attivazione reticolare ascendente ricostruito sono mostrati a ciascun livello del cervello in un soggetto normale (maschio di 26 anni).
Analisi statistica
Il software SPSS (v.15.0; SPSS, Chicago, IL, USA) è stato utilizzato per lanalisi dei dati. Il test t accoppiato è stato utilizzato per determinare la differenza nei valori dei parametri DTI dellARAS tra gli emisferi destro e sinistro. Il test di correlazione di Pearson è stato utilizzato per determinare la correlazione tra i parametri DTI dellARAS e letà. I risultati sono stati considerati significativi quando il valore p era < 0,05.
Risultati
Abbiamo ricostruito il singolo componente inferiore dellARAS tra i pontini RF e nuclei intralaminari del talamo. La componente ricostruita dellARAS ha avuto origine dalla RF pontina, ascesa attraverso il tegmento mesencefalico appena posteriormente al nucleo rosso, e poi è terminata sui nuclei intralaminari del talamo a livello del piano commissurale in tutti i soggetti (Figura 1B).
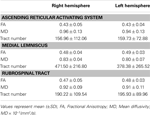
Tabella 1. Parametri di imaging del tensore di diffusione del sistema di attivazione reticolare ascendente .
Discussione
In questo studio, utilizzando DTI, abbiamo ricostruito uno dei percorsi principali di lARAS, il singolo componente inferiore dellARAS dalla RF al talamo nei soggetti normali, sebbene lARAS sia costituito da ulteriori nuclei del tronco cerebrale, ipotalamo, proencefalo basale e proiezioni talamocorticali alla corteccia cerebrale. Abbiamo selezionato due ROI per la ricostruzione del singolo componente inferiore dellARAS: il seed ROI, che era lRF del ponte a livello della zona di ingresso del nervo trigemino (Daube, 1986; Afifi e Bergman, 2005), e il target ROI, che includeva i nuclei intralaminari del talamo (nuclei laterali centrali, nuclei centromediano / parafascicolare e nuclei paracentrale) a livello del piano commissurale (Morel, 2007). La porzione rostrale della RF del tronco cerebrale sopra la zona di ingresso del nervo trigemino è nota come ARAS; al contrario, la porzione caudale della RF è coinvolta nella funzione motoria e nella funzione autonomica correlata alla funzione cardiaca e respiratoria (Daube, 1986). Pertanto, abbiamo posizionato il ROI del seme nella RF a livello della zona di ingresso del nervo trigemino. Abbiamo posizionato il ROI target nei nuclei intralaminari, che sono i nuclei principali dellARAS tra i nuclei talamici non specifici. Pertanto, riteniamo che, poiché non abbiamo potuto includere gli altri nuclei talamici interessati allARAS, il singolo componente inferiore dellARAS che è stato ricostruito nello studio attuale non è lintero singolo componente inferiore dellARAS, ma la porzione principale dellARAS intero singolo componente inferiore dellARAS.Di conseguenza, il singolo componente inferiore dellARAS proveniva dalla RF pontina, ascendeva attraverso il tegmento mesencefalico posteriore al nucleo rosso, e poi terminava sui nuclei intralaminari del talamo. Inoltre, i valori per FA, MD e numeri di tratto del singolo componente inferiore ricostruito dellARAS non differivano significativamente tra lemisfero destro e quello sinistro. Il numero del tratto è determinato dal numero di voxel contenuti in un tratto neurale (Kwak et al., 2010). Il valore FA indica il grado di direzionalità e integrità delle microstrutture della sostanza bianca come assoni, mielina e microtubuli e il valore ADC indica lentità della diffusione dellacqua (Assaf e Pasternak, 2008).
Diversi studi hanno dimostrato lutilità clinica della DTI stimando alcune aree del singolo componente inferiore dellARAS dalla RF al talamo in pazienti con ridotta coscienza (Perlbarg et al., 2009; Tollard et al., 2009; Newcombe et al., 2010; Fernandez-Espejo et al., 2011). Tollard et al. (2009) hanno riferito sullutilità della DTI, che è stata eseguita nella fase subacuta per la previsione del risultato in 45 pazienti con trauma cranico grave (lesione cerebrale traumatica) (assenza di risposta a ordini semplici). Nel loro studio, hanno misurato il valore FA in diverse aree sopratentoriali e infratentoriali, inclusi il ponte anteriore, il ponte posteriore e il mesencefalo, e hanno dimostrato che la diminuzione della FA infratentoriale e sopratentoriale, ad eccezione dei ponti posteriori, consentiva la previsione di risultati sfavorevoli 1 anno da TBI. Perlbarg et al. (2009), che hanno eseguito la scansione DTI in 30 pazienti con assenza di risposta a ordini semplici a seguito di trauma cranico grave, hanno riportato una netta diminuzione della FA misurata nel fascicolo longitudinale inferiore, mesencefalo (peduncolo cerebrale e tegmento), arto posteriore della capsula interna e corpo calloso posteriore nel gruppo con esiti sfavorevoli. Newcombe et al. (2010) hanno utilizzato DTI per caratterizzare lentità e la localizzazione della perdita di sostanza bianca in pazienti che erano in uno stato vegetativo secondario a trauma cranico (sette pazienti) e pazienti con danno ischemico-ipossico (cinque pazienti). Anomalie nelle aree sovratentoriali sono state osservate in entrambi i gruppi; al contrario, le anomalie del tronco cerebrale sono state osservate solo nel gruppo TBI. Fernandez-Espejo et al. (2011) hanno utilizzato DTI nella differenziazione della neuropatologia di 25 pazienti vegetativi e minimamente coscienti. Hanno concluso che i pazienti con scarsa coscienza e quelli in stato vegetativo differivano nella sostanza bianca sottocorticale e nelle regioni talamiche, ma non sembravano differire nel tronco cerebrale. In un recente studio che utilizzava limaging a diffusione ad alta risoluzione angolare, Edlow et al. (2012) hanno riportato sulla connettività neuroanatomica dellARAS nel cervello umano, sia in vivo che ex vivo. Hanno dimostrato che le connettività di specifici nuclei ARAS erano implicate nelleccitazione e quelle dei nuclei talamici erano implicate nella modulazione delleccitazione.
In conclusione, utilizzando DTI, abbiamo ricostruito il singolo componente inferiore dellARAS dal RF al talamo nel cervello umano. Riteniamo che la metodologia utilizzata ei risultati di questo studio possano essere utili ai ricercatori che studiano lARAS nel cervello umano. Tuttavia, uno dei limiti di questo studio è che non siamo stati in grado di chiarire completamente lintero sistema ARAS perché non abbiamo incluso nella nostra analisi altri nuclei talamici e del tronco cerebrale che sono anche coinvolti nellARAS. Sono necessari ulteriori studi sullutilità clinica dei nostri risultati e studi sulle proiezioni dellARAS dal talamo alla corteccia cerebrale.
Conflitto di interessi
Dichiarano gli autori che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Ringraziamenti
Questo lavoro è stato sostenuto dal DGIST R & D Programma del Ministero dellIstruzione, della Scienza e della Tecnologia della Corea (13-BD-0401).
Afifi, AK e Bergman, RA (2005). Neuroanatomia funzionale: testo e atlante. New York: Lange Medical Books / McGraw-Hill.
Morel, A. (2007). Atlante stereotassico del talamo umano e dei gangli basali. New York: Informa Healthcare.