9.9 Unintroduzione alla sintesi organica
Obiettivo
Dopo aver completato questa sezione, dovresti essere in grado di progettare una sintesi multistep per preparare un dato prodotto da un dato materiale di partenza, utilizzando una qualsiasi delle reazioni introdotte nel libro di testo fino a questo punto.
Note di studio
Dovresti hanno notato che alcuni dei problemi assegnati hanno richiesto di mettere insieme una serie di reazioni organiche per convertire un composto organico in un altro quando non esiste ununica reazione per raggiungere questo obiettivo. Una tale serie di reazioni è chiamata “sintesi organica”. Uno degli obiettivi principali di questo corso è quello di assisterti nella progettazione di tali sintesi. Per raggiungere questo obiettivo, dovrai avere a disposizione nella tua memoria tutte le reazioni descritte nel corso. Dovrai ricordare alcune reazioni molto più frequentemente rispetto ad altri, e lunico modo per padroneggiare questo obiettivo è fare pratica. Gli esempi forniti in questo capitolo saranno relativamente semplici, ma vedrai presto che puoi escogitare alcune sintesi piuttosto sofisticate usando un numero limitato di reazioni di base.
Lo studio della chimica organica espone uno studente a unampia gamma di reazioni correlate. Gli alcheni, ad esempio, possono essere convertiti in alcani, alcoli, alogenuri alchilici, epossidi, glicoli e borani strutturalmente simili; piccole aldeidi, chetoni e acidi carbossilici; e ampliati da carbocatione e aggiunte di radicali, nonché cicloaddizioni. Tutti questi prodotti possono essere trasformati successivamente in una miriade di nuovi composti che incorporano unampia varietà tà di gruppi funzionali, e quindi aperti a ulteriori elaborazioni. Di conseguenza, la concezione logica di una sintesi a più fasi per la costruzione di un composto designato da un materiale di partenza specificato diventa uno dei problemi più impegnativi che possono essere posti.
Una sequenza di uno o due passaggi di semplici reazioni è non così difficile da dedurre. Se, ad esempio, viene chiesto di preparare il meso-3,4-esandiolo dal 3-esino, la maggior parte degli studenti si rende conto che sarà necessario ridurre lalchino a cis o trans-3-esene prima di intraprendere la formazione del glicole. Lidrossilazione del permanaganato o del tetrossido di osmio del cis-3-esene formerebbe il meso isomero desiderato. Dal trans-3-esene sarebbe necessario prima epossidare lalchene con un peracido, seguito dallapertura dellanello con ione idrossido. Questo esempio illustra una caratteristica comune in sintesi: spesso esiste più di una procedura efficace che porta al prodotto desiderato.
Sintesi a più fasi più lunghe richiedono unanalisi e una riflessione attente, poiché è necessario considerare molte opzioni. Come un esperto giocatore di scacchi che valuta i pro ei contro a lungo raggio delle potenziali mosse, il chimico deve valutare il potenziale successo di vari possibili percorsi di reazione, concentrandosi sulla portata e sui limiti che vincolano ciascuna delle singole reazioni impiegate. Questo può essere un compito arduo, la cui abilità viene acquisita dallesperienza e spesso per tentativi ed errori.
I tre esempi mostrati di seguito sono illustrativi. Il primo è un semplice problema di conversione del gruppo funzionale, che inizialmente può sembrare difficile. Spesso è utile lavorare a ritroso tali problemi, partendo dal prodotto. In questo caso dovrebbe essere evidente che il cicloesanolo può essere sostituito al cicloesanone, poiché questultimo potrebbe quindi essere prodotto da una semplice ossidazione. Inoltre, poiché il cicloesano (e gli alcani in generale) è relativamente non reattivo, la bromurazione (o clorurazione) sembrerebbe essere un primo passo ovvio. A questo punto si è tentati di convertire il bromocicloesano in cicloesanolo mediante una reazione SN2 con ione idrossido. Questa reazione sarebbe senza dubbio accompagnata dalleliminazione di E2, quindi sarebbe più pulito, anche se un passaggio più lungo, produrre prima il cicloesene e poi idratarlo con uno qualsiasi dei diversi metodi (es. Ossimercurazione e idroborazione) compreso quello mostrato cliccando sul diagramma
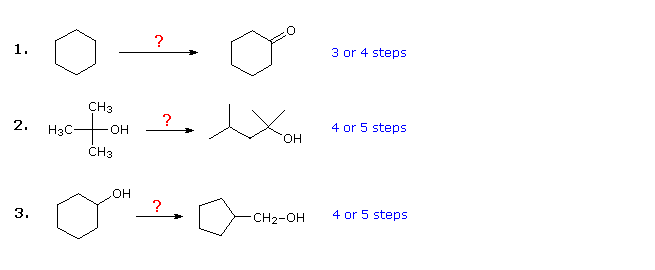 Risposta
Risposta
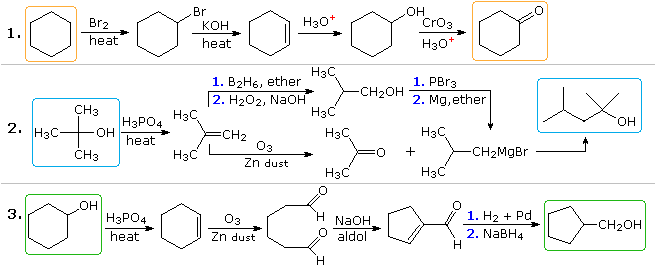
Le soluzioni plausibili per il secondo e terzo problema verranno visualizzate anche sopra a questo punto. Nel problema 2 il prodotto desiderato ha sette atomi di carbonio e il materiale di partenza ne ha quattro. Chiaramente, due intermedi derivati dal composto di partenza devono essere uniti insieme e un carbonio deve essere perso, prima o dopo che questo legame ha luogo. La funzione 3º-alcol nel prodotto suggerisce la formazione mediante laggiunta di Grignard a un chetone e lisobutene sembra essere un buon precursore di ciascuno di questi reagenti, come mostrato. Il reagente e i composti del prodotto nel terzo problema sono isomeri, ma è chiaramente necessario un qualche tipo di sequenza di rottura del legame e di creazione del legame affinché si verifichi questo cambiamento strutturale. Una possibile procedura è mostrata sopra. Potrebbe anche servire il riarrangiamento catalizzato da acido dellossido di cicloesene, seguito da riduzione.
Lutile approccio di elaborare sintesi partendo dalla molecola bersaglio e lavorare a ritroso verso materiali di partenza più semplici è stato formalizzato dal Prof. E. J. Corey (Harvard) e definito analisi retrosintetica. In questa procedura la molecola bersaglio viene trasformata progressivamente in strutture più semplici scollegando legami carbonio-carbonio selezionati. Queste disconnessioni si basano su trasformazioni, che sono il contrario di plausibili costruzioni sintetiche. Ogni struttura più semplice, così generata, diventa il punto di partenza per ulteriori disconnessioni, portando a un insieme ramificato di intermedi correlati. Una trasformazione retrosintetica è rappresentata dal simbolo = >, come mostrato di seguito per gli esempi precedenti 2 & 3. Dopo aver condotto unanalisi completa , la sintesi desiderata può essere eseguita applicando le reazioni sottostanti le trasformazioni.
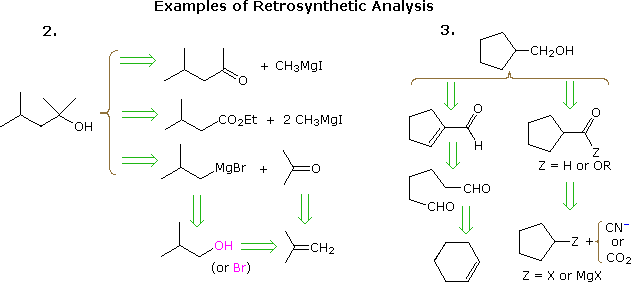
Il diagramma sopra non fornisce un set completo di trasformazioni per questi target composti. Quando viene specificato un materiale di partenza, come nei problemi precedenti, i percorsi proposti devono riflettere quel vincolo. Quindi le opzioni di 4-metil-2-pentanone e 3-metilbutirrato dellesempio 2, sebbene del tutto ragionevoli, non si adattano bene con un inizio di terz-butanolo. Allo stesso modo, un intermedio ciclopentilico potrebbe fornire un percorso eccellente al prodotto nellesempio 3, ma non soddisfa le condizioni specificate del problema.
Lanalisi retrosintetica è particolarmente utile quando si considerano molecole relativamente complesse senza vincoli di materiale iniziale. Se viene condotto senza pregiudizi, a volte compaiono possibilità insolite e intriganti. Sfortunatamente, la complessità molecolare (composta da dimensioni, funzionalità, incorporazione di eteroatomi, connettività ciclica e stereoisomerismo) porta generalmente ad alberi di trasformazione molto grandi e ampiamente ramificati. Lanalisi assistita dal computer si è dimostrata utile, ma alla fine listinto e lesperienza del chimico giocano un ruolo fondamentale per arrivare a un piano sintetico di successo. Di seguito vengono forniti alcuni esempi relativamente semplici, la maggior parte con limitazioni materiali iniziali.
Esercizi
Domande
Q9.9.1
Partendo da 3-hexyne, prevedere percorsi sintetici per ottenere:
A – cis-3-hexene
B – 3,4-dibromohexane
C – 3-esanolo
Q9.9.2
Partendo dallacetilene e da eventuali alogenuri alchilici, si propone una sintesi per produrre (a) pentanale e (b) esano.
Soluzioni
S9.9.1

S9.9.2
.png?revision=1)
Collaboratori e Attribuzioni
-
Dr. Dietmar Kennepohl FCIC (Professore di Chimica, Athabasca University)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, Professore Emerito (Michigan State U.), Libro di testo virtuale di chimica organica