12.2: Rapporti molari
Rapporti molari
I problemi di stechiometria possono essere caratterizzati da due cose: (1) le informazioni fornite nel problema e (2) le informazioni che devono essere risolte, denominate sconosciute. Il dato e lignoto possono essere entrambi reagenti, entrambi prodotti oppure uno può essere un reagente mentre laltro è un prodotto. Le quantità delle sostanze possono essere espresse in moli. Tuttavia, in una situazione di laboratorio, è comune determinare la quantità di una sostanza trovando la sua massa in grammi. La quantità di una sostanza gassosa può essere espressa dal suo volume. In questo concetto, ci concentreremo sul tipo di problema in cui sia la quantità data che quella sconosciuta sono espresse in moli.

Le equazioni chimiche esprimono le quantità di reagenti e prodotti in a reagenti e prodotti in una reazione. I coefficienti di unequazione bilanciata possono rappresentare il numero di molecole o il numero di moli di ciascuna sostanza. La produzione di ammoniaca \ (\ left (\ ce {NH_3} \ right) \) da azoto e idrogeno è unimportante reazione industriale chiamata processo Haber, dal nome del chimico tedesco Fritz Haber.
\
Lequazione bilanciata può essere analizzata in diversi modi, come mostrato nella figura seguente.
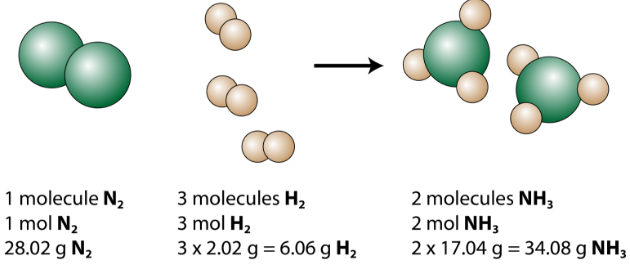
Vediamo che 1 molecola di azoto reagisce con 3 molecole di idrogeno per formare 2 molecole di ammoniaca. Questa è la quantità relativa più piccola possibile dei reagenti e dei prodotti. Per considerare importi relativi maggiori, ogni coefficiente può essere moltiplicato per lo stesso numero. Ad esempio, 10 molecole di azoto reagirebbero con 30 molecole di idrogeno per produrre 20 molecole di ammoniaca.
La quantità più utile per contare le particelle è la talpa. Quindi, se ogni coefficiente viene moltiplicato per una mole, lequazione chimica bilanciata ci dice che 1 mole di azoto reagisce con 3 moli di idrogeno per produrre 2 moli di ammoniaca. Questo è il modo convenzionale per interpretare qualsiasi equazione chimica bilanciata.
\
La massa e il numero di atomi devono essere conservati in qualsiasi reazione chimica. Il numero di molecole non è necessariamente conservato.

Un rapporto molare è un fattore di conversione che mette in relazione le quantità in moli di due sostanze qualsiasi in una reazione chimica. I numeri in un fattore di conversione derivano dai coefficienti dellequazione chimica bilanciata. I seguenti sei rapporti molari possono essere scritti per la reazione di formazione dellammoniaca sopra.
In un problema di rapporto molare, la sostanza data, espressa in moli, viene scritta per prima. Il fattore di conversione appropriato viene scelto per convertire le moli della sostanza data in moli dellignoto.