Határok az emberi idegtudományban
Bevezetés
A tudatosság a környezet és az ön felébresztése és tudatossága, amelyet a felmenő retikuláris aktiváló rendszer (ARAS) működésével érünk el az agytörzs és az agykéreg (Daube, 1986; Paus, 2000; Zeman, 2001; Gosseries et al., 2011). Az ARAS több neuronális áramkörből áll, amelyek összekapcsolják az agytörzset a kéreggel. Ezek a neuronális kapcsolatok főleg az agytörzs retikuláris képződéséből (RF) származnak, és a thalamus intralamináris magjában lévő szinaptikus relék révén vetülnek az agykéregbe (Daube, 1986; Paus, 2000; Zeman, 2001; Afifi és Bergman, 2005; Gosseries és mtsai., 2011). Ezenkívül számos agytörzsi mag (locus coeruleus, dorsalis raphe, medián raphe, pedunculopontine mag, parabrachialis mag), nem specifikus talamusz mag, hipotalamusz és bazális előagy is szerepel az ARAS rendszerben (Aston-Jones et al., 2001 ; Parvizi és Damasio, 2003; Fuller és mtsai, 2011). Az ARAS alapos értékelése fontos a tudatzavarral küzdő betegek diagnosztizálásához és kezeléséhez, például vegetatív állapotú vagy minimális tudatú betegek diagnosztizálásához és kezeléséhez (Zeman, 2001; Gosseries et al., 2011).
Hagyományos agyi MRI-t, funkcionális idegépalkotó technikákat, elektrofiziológiai módszereket és MR-spektroszkópiát alkalmaztak az ARAS emberi agyban végzett vizsgálataiban (Parvizi és Damasio, 2003; Schiff, 2006; Tshibanda et al., 2009, 2010; Gawryluk et al. ., 2010). Mivel azonban az ARAS-t nem lehet egyértelműen megkülönböztetni a szomszédos idegstruktúráktól, az ARAS pontos azonosítása és becslése az emberi agyban problematikus lehet e módszerek alkalmazásakor. Ezzel szemben a diffúziós tenzor képalkotás (DTI) lehetővé teszi a fehér anyag értékelését, mivel képes képezni a víz diffúziós jellemzőit (Mori et al., 1999). Normál fehéranyagban a vízmolekulák relatív mozgásszabadsággal rendelkeznek, párhuzamosan az idegrost traktusokkal. Mozgásuk azonban korlátozott a traktusokon keresztül, ami a fehér anyag diffúziós anizotropiáját eredményezi. Ennek megfelelően diffúziós anizotropiát alkalmaztak a fehéranyag rostváltozásának mértékének értékelésére (Chang és mtsai., 2010; Puig és mtsai., 2010). Számos újabb tanulmány megkísérelte bemutatni a DTI hasznosságát az elváltozások értékelésében olyan betegeknél, akiknél a tudatzavar és az emberi agy specifikus ARAS-magjainak összekapcsolhatósága van (Voss és mtsai, 2006; Perlbarg és mtsai, 2009; Tollard és mtsai, 2009; Tshibanda és mtsai., 2009; Fernandez-Espejo és mtsai, 2010, 2011; Newcombe és mtsai., 2010; Edlow és mtsai, 2012). Kevéssé ismert azonban az ARAS teljes rekonstrukciója és becslése az emberi agyban (Edlow és mtsai, 2012).
A jelenlegi tanulmányban a DTI segítségével megkíséreltük rekonstruálni az alsó egyetlen komponenst az ARAS pontintikus RF-től a thalamus intralamináris magjáig a normál emberi agyban.
Anyagok és módszerek
Témák
Huszonhat normál egészséges alany (14 férfit, 12 nőt; átlagos életkor, 31,85 ± 9,80 év; tartomány, 20–50) vettek fel, anamnézisükben nem volt neurológiai betegség. Valamennyi alany önkéntesként vett részt ebben a vizsgálatban, és írásbeli beleegyezést adott, mielőtt átesett volna a DTI-vizsgálaton. A vizsgálatot kórházunk intézményi felülvizsgálati testülete jóváhagyta.
Diffúziós tenzor kép
A DTI-adatokat 6 csatornás fejtekercs segítségével szereztük be egy 1,5 tonnás Philips Gyroscan Intera-n ( Philips, Best, Hollandia), egy felvételes echo-planar képalkotással. A 32 nem kollináris diffúzióval szenzibilizáló gradiens mindegyikéhez 67 összefüggő szeletet szereztünk, amelyek párhuzamosak voltak az elülső commissure-posterior commissure vonallal. A képalkotó paraméterek a következők voltak: felvételi mátrix = 96 × 96, mátrixra rekonstruálva = 128 × 128, látómező = 221 mm × 221 mm, TR = 10 726 ms, TE = 76 ms, párhuzamos képcsökkentési tényező (SENSE faktor) = 2, EPI-tényező = 49, és b = 1000 s / mm2, NEX = 1, és a szelet vastagsága 2,3 mm (megszerzett izotróp voxelméret 2,3 mm × 2,3 mm × 2,3 mm).
Valószínűségi rost Nyomkövetés
A diffúzióval súlyozott képalkotó adatok elemzését az Oxford Center for Brain Magnetic Resonance Imaging of Brain (FMRIB) szoftverkönyvtár (FSL; www.fmrib.ox.ac.uk/fsl) segítségével végeztük. Az affin többlépcsős kétdimenziós regisztrációval korrigálták a fej mozgásának hatását és az örvényáram miatti képtorzulást. A szálkövetést valószínűségi traktográfiai módszerrel végeztük, amely többszálas modellen alapult, és a jelenlegi tanulmányban az FMRIB Diffusionban megvalósított traktográfiai rutinokat alkalmazták (5000 áramvonalas minta, 0,5 mm lépéshosszúság, görbületi küszöbérték = 0,2) (Smith és mtsai, 2004 ).A valószínűségi traktográfia előnyei, amelyet ebben a tanulmányban alkalmaztak, többek között a robusztusabb zajzavar, valamint az élesebb szögű utak észlelésének és az keresztező szálak megkülönböztetésének képessége (Behrens és mtsai, 2007; Winston és mtsai, 2011).
Az ARAS útvonalát az érdeklődésre számot tartó magterületeken (ROI) és a cél (befejeződés) ROI-n áthaladó szálak kiválasztásával határoztuk meg. A magok ROI-ját a ponok RF-jére helyeztük a trigeminus ideg belépési zónájának szintjén (Daube, 1986; Afifi és Bergman, 2005). A medialis lemniscus és a rubrospinalis traktus elemzését végeztük annak érdekében, hogy megerősítsük az RF határát a pónokon (1A. Ábra). A medialis lemniscus elemzéséhez a mag ROI-kat az anteromedialis medullára, a megcélzott ROI-t pedig a szomatoszenzoros kéregre helyeztük (Hong et al., 2010). A rubrospinalis traktus elemzéséhez a mag ROI-kat a vörös magra helyezték, a cél ROI-t pedig a medulla (Monakow területe) kontralaterális dorsolateralis régiójára (Nathan és Smith, 1982; Kwon et al., 2011). A megcélzott ROI értéket a talamusz intralamináris magjain adtuk meg a komissziós sík szintjén (Morel, 2007). A thalamus intralamináris magjainak meghatározásakor agyatlaszra (Morel, 2007) utaltunk (1A. Ábra). A magvoxelből előállított 5000 minta közül az érintkezés eredményeit legalább 1 küszöbértékkel vizualizálták elemzés céljából. Megmértük a frakcionált anizotropia (FA), az átlagos diffúzió (MD) és az ARAS alsó egyetlen komponensének traktusszámát.
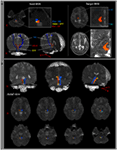
1. ábra. (A) A pontine retikuláris képződményen (vörös szín) megadják az érdekes magterületeket (ROI). A megcélzott ROI-t a thalamus intralamináris magjainál adjuk meg a commissuralis sík szintjén. A thalamus intralamináris magjainak határát az agy atlaszának tankönyvére hivatkozva határoztuk meg (Morel, 2007). ML, medialis lemniscus; RST, rubrospinalis traktus; RF, retikuláris képződés; AC, elülső commissure; PC, hátsó commissure. (B) A rekonstruált felmenő retikuláris aktiváló rendszer útvonala az agy minden szintjén látható egy normál alanynál (26 éves férfi).
Statisztikai elemzés
Az adatok elemzéséhez SPSS szoftvert (v.15.0; SPSS, Chicago, IL, USA) használtunk. Párosított t-próbát alkalmaztunk az ARAS jobb és bal agyfélteke közötti DTI-paramétereinek értékkülönbségének meghatározására. Pearson-korrelációs tesztet használtunk az ARAS DTI-paraméterei és az életkor közötti korreláció meghatározására. Az eredményeket akkor tekintettük szignifikánsnak, amikor a p érték < 0,05.
Eredmények
Rekonstruáltuk az ARAS alsó egyetlen alkotórészét a pontine között A thalamus RF és intralamináris magjai. Az ARAS rekonstruált komponense a pontine RF-ből származott, felemelkedett a mesencephalic tegmentumon keresztül, közvetlenül a vörös mag mögött, majd a thalamus intralamináris magjain ért véget a commissuralis sík szintjén minden alanyban (1B ábra). / p>
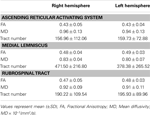
1. táblázat: A felszálló retikuláris aktiváló rendszer diffúziós tenzoros képalkotó paraméterei .
Megbeszélés
A jelenlegi tanulmányban a DTI segítségével rekonstruáltuk a az ARAS, az ARAS alsó egyetlen alkotóeleme az RF-től a thalamusig normál személyeknél, bár az ARAS további agytörzsi magokból, hipotalamuszból, bazális előagyból és thalamocorticalis vetületekből áll az agykéreg felé. Két ROI-t választottunk az ARAS alsó egyetlen alkotóelemének rekonstrukciójára: a mag ROI-t, amely a ponok RF-je volt a trigeminus ideg belépési zónájának szintjén (Daube, 1986; Afifi és Bergman, 2005), valamint a célt. ROI, amely magában foglalta a thalamus intralamináris magjait (a központi laterális magokat, a centromédiás / parafascicularis magokat és a paracentralis magokat) a commissuralis sík szintjén (Morel, 2007). Az agytörzs RF rostralis része a trigeminus ideg belépési zónája felett ARAS néven ismert; ezzel szemben az RF kaudális része részt vesz a szív és a légzés működésével kapcsolatos motoros és autonóm funkciókban (Daube, 1986). Ezért a mag ROI-t az RF-be helyeztük a trigeminus ideg belépési zónájának szintjén. A cél ROI-t az intralamináris magokba helyeztük, amelyek az ARAS fő magjai a nem specifikus talamikus magok között. Ezért úgy gondoljuk, hogy mivel nem tudtuk bevonni az ARAS-szal foglalkozó többi thalamus magot, az ARAS jelenlegi egyetlen tanulmányának rekonstrukciója, amelyet a jelen tanulmány rekonstruált, nem az ARAS teljes alsó egyetlen alkotóeleme, hanem a az ARAS teljes alsó egyetlen alkotóeleme.Következésképpen az ARAS alsó egyetlen alkotóeleme a pontine RF-ből származott, felemelkedett a mezencephalic tegmentumon keresztül a vörös mag felé, majd a thalamus intralamináris magjain ért véget. Ezenkívül az ARAS rekonstruált alsó egyetlen alkotóelemének FA, MD és traktusszámának értékei nem különböztek szignifikánsan a jobb és a bal agyféltekén. A traktus számát az idegi traktusban lévő voxelek száma határozza meg (Kwak et al., 2010). Az FA érték a fehérállományú mikrostruktúrák, például axonok, mielin és mikrotubulusok irányíthatóságának és integritásának mértékét, az ADC érték pedig a víz diffúziójának nagyságát jelzi (Assaf és Pasternak, 2008).
Több tanulmány bebizonyították a DTI klinikai hasznosságát az ARAS alsó egyetlen komponensének egyes területeinek becslésével az RF-től a thalamusig tudatzavaros betegeknél (Perlbarg et al., 2009; Tollard et al., 2009; Newcombe et al. 2010; Fernandez-Espejo et al., 2011). Tollard és mtsai. (2009) beszámolt a DTI hasznosságáról, amelyet a szubakut stádiumban végeztek az eredmény előrejelzésére 45 súlyos TBI-ben (traumás agysérülés) szenvedő beteg esetében (az egyszerű megrendelésekre adott válasz hiánya). Vizsgálatuk során számos szupratentoriális és infratentorális területen, köztük az elülső, a hátsó és a középagyon mérték az FA értékét, és kimutatták, hogy az infratentorális és a szupratentoriális FA csökkenése lehetővé tette a kedvezőtlen eredmények előrejelzését 1 év a TBI-től. Perlbarg és mtsai. (2009), aki a súlyos TBI-t követően 30 betegnél végzett DTI-vizsgálatot egyszerű válaszra adott válasz nélkül, az FA határozott csökkenéséről számolt be az alsó longitudinális fasciculusban, a középagyban (agyi kocsány és tegmentum), a belső kapszula hátsó végtagjában mérve. , valamint a hátsó corpus callosum a kedvezőtlen eredménycsoportban. Newcombe és mtsai. (2010) a DTI-t használta a fehéranyag-veszteség mértékének és helyének jellemzésére a TBI miatt másodlagos vegetatív állapotban lévő betegeknél (hét beteg) és az ischaemiás-hypoxiás sérüléssel küzdő betegeknél (öt beteg). Mindkét csoportban rendellenességeket figyeltek meg a supratentorialis területeken; ezzel szemben az agytörzs rendellenességeit csak a TBI csoportban figyelték meg. Fernandez-Espejo és mtsai. (2011) 25 vegetatív és minimálisan tudatos beteg neuropatológiájának differenciálásában használta a DTI-t. Arra a következtetésre jutottak, hogy a minimálisan tudatos betegek és a vegetatív állapotban lévők különböznek a subkortikális fehérállományban és a thalamus régióiban, de az agytörzsben nem különböznek egymástól. Egy nemrégiben végzett, nagy szögfelbontású diffúziós képalkotást alkalmazó tanulmányban Edlow és mtsai. (2012) beszámolt az ARAS neuroanatómiai összekapcsolhatóságáról az emberi agyban, in vivo és ex vivo egyaránt. Kimutatták, hogy a specifikus ARAS-sejtek összekapcsolhatósága szerepet játszik az izgalomban, a thalamus-sejteké pedig az izgalom modulálásában.
Összefoglalva, a DTI segítségével rekonstruáltuk az ARAS alsó egyetlen komponensét a RF az emberi agy thalamusához. Úgy gondoljuk, hogy az alkalmazott módszer és a tanulmány eredményei hasznosak lehetnek az emberi agyban az ARAS-t tanulmányozó kutatók számára. Ennek a tanulmánynak azonban az egyik korlátja, hogy nem tudtuk teljes mértékben megvilágítani a teljes ARAS rendszert, mert elemzésünkbe nem vettünk be más thalamus és agytörzsi magokat, amelyek szintén részt vesznek az ARAS-ban. További vizsgálatok szükségesek eredményeink klinikai hasznosságáról, valamint tanulmányok szükségesek az ARAS thalamustól az agykéregig terjedő vetületeire.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
Köszönetnyilvánítás
Ezt a munkát a DGIST R & Koreai Oktatási, Tudományos és Technológiai Minisztérium D programja (13-BD-0401).
Afifi, AK, és Bergman, RA (2005). Funkcionális neuroanatómia: szöveg és atlasz. New York: Lange Medical Books / McGraw-Hill.
Morel, A. (2007). Az emberi Thalamus és Basal Ganglia sztereotaktikus atlasza. New York: Informa Healthcare.