12.2: Mólarányok
Mólarányok
A sztöchiometriai problémákat két dolog jellemezheti: (1) a problémában megadott információk, és (2) a megoldandó információ, amelyet ismeretlennek nevezünk. A megadott és az ismeretlen egyaránt lehet reagens, mindkettő termék, vagy az egyik lehet reagens, míg a másik termék. Az anyagok mennyisége kifejezhető molban. Laboratóriumi helyzetben azonban gyakran meghatározzák az anyag mennyiségét úgy, hogy tömegét grammban állapítják meg. A gáz halmazállapotú anyag mennyiségét térfogatában is kifejezhetjük. Ebben a koncepcióban arra a problématípusra fogunk összpontosítani, ahol az adott és az ismeretlen mennyiség is molban van kifejezve.

A kémiai egyenletek a reagensek és termékek mennyiségét fejezik ki a reaktánsok és a reakció során keletkező termékek. A kiegyensúlyozott egyenlet együtthatói képviselhetik az egyes anyagok molekuláinak számát vagy molszámait. Az ammónia \ (\ bal (\ ce {NH_3} \ jobb) \) előállítása nitrogén- és hidrogéngázokból fontos ipari reakció, az úgynevezett Haber-folyamat, Fritz Haber német kémikus után.
\
A kiegyensúlyozott egyenlet többféle módon elemezhető, amint az az alábbi ábrán látható.
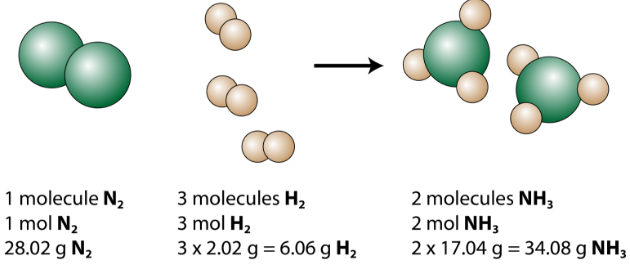
Látjuk, hogy 1 nitrogénmolekula 3 hidrogénmolekulával 2 ammóniamolekulát képez. Ez a lehető legkisebb relatív mennyiségű reagens és termék. Nagyobb relatív összegek figyelembevételéhez az egyes együtthatók ugyanazzal a számmal szorozhatók. Például 10 nitrogénmolekula reagál 30 hidrogénmolekulával 20 molekula ammónia előállításához.
A részecskék számlálásához a leghasznosabb mennyiség a mol. Tehát, ha mindegyik együtthatót megszorozzuk egy moldal, a kiegyensúlyozott kémiai egyenlet azt mondja nekünk, hogy 1 mol nitrogén 3 mol hidrogénnel reagálva 2 mol ammóniát termel. Ez a kiegyensúlyozott kémiai egyenletek értelmezésének hagyományos módja.
\
A kémiai reakciók során meg kell őrizni a tömeg és az atomok számát. A molekulák száma nem feltétlenül konzervált.

A mólarány olyan konverziós tényező, amely a kémiai reakció bármely két anyagának molban lévő mennyiségét viszonyítja. A konverziós tényezőben szereplő számok a kiegyensúlyozott kémiai egyenlet együtthatóiból származnak. A fenti hat mólarány írható a fenti ammóniaképző reakcióra.
Mólarány-probléma esetén az adott anyagot molban kifejezve írják először. A megfelelő konverziós tényezőt úgy választják meg, hogy az adott anyag moljaiból ismeretlen molokká alakuljon át.