Frontiers in Human Neuroscience (Deutsch)
Einführung
Bewusstsein ist eine Erregung und ein Bewusstsein für Umwelt und Selbst, die durch die Wirkung des aufsteigenden retikulären Aktivierungssystems (ARAS) erreicht werden der Hirnstamm und die Großhirnrinde (Daube, 1986; Paus, 2000; Zeman, 2001; Gosseries et al., 2011). Das ARAS besteht aus mehreren neuronalen Schaltkreisen, die den Hirnstamm mit dem Kortex verbinden. Diese neuronalen Verbindungen entstehen hauptsächlich in der retikulären Bildung (RF) des Hirnstamms und projizieren durch synaptische Relais im intralaminaren Kern des Thalamus zur Großhirnrinde (Daube, 1986; Paus, 2000; Zeman, 2001; Afifi und Bergman, 2005; Gosseries et al., 2011). Darüber hinaus sind im ARAS-System auch mehrere Hirnstammkerne (Locus coeruleus, Dorsalraphe, Medianraphe, Pedunculopontin-Kern, Parabrachialkern), unspezifische Thalamuskerne, Hypothalamus und basales Vorderhirn enthalten (Aston-Jones et al., 2001) ; Parvizi und Damasio, 2003; Fuller et al., 2011). Eine gründliche Bewertung des ARAS ist wichtig für die Diagnose und Behandlung von Patienten mit Bewusstseinsstörungen, z. B. Patienten in einem vegetativen Zustand oder Patienten mit minimalem Bewusstsein (Zeman, 2001; Gosseries et al., 2011).
Konventionelle Hirn-MRT, funktionelle Neuroimaging-Techniken, elektrophysiologische Methoden und MR-Spektroskopie wurden in Studien zum ARAS im menschlichen Gehirn verwendet (Parvizi und Damasio, 2003; Schiff, 2006; Tshibanda et al., 2009, 2010; Gawryluk et al ., 2010). Da das ARAS jedoch nicht klar von benachbarten neuronalen Strukturen unterschieden werden kann, kann eine genaue Identifizierung und Schätzung des ARAS im menschlichen Gehirn bei Verwendung dieser Methoden problematisch sein. Im Gegensatz dazu ermöglicht die Diffusionstensor-Bildgebung (DTI) die Bewertung der weißen Substanz aufgrund ihrer Fähigkeit, Wasserdiffusionseigenschaften abzubilden (Mori et al., 1999). In normaler weißer Substanz haben Wassermoleküle eine relative Bewegungsfreiheit parallel zu Nervenfasertrakten. Ihre Bewegungen sind jedoch über die Trakte beschränkt, was zu einer Diffusionsanisotropie der weißen Substanz führt. Dementsprechend wurde die Diffusionsanisotropie zur Bewertung des Ausmaßes der Faseränderung in der weißen Substanz verwendet (Chang et al., 2010; Puig et al., 2010). Mehrere neuere Studien haben versucht, die Nützlichkeit von DTI für die Bewertung von Läsionen bei Patienten mit Bewusstseinsstörungen und Konnektivität spezifischer ARAS-Kerne im menschlichen Gehirn zu demonstrieren (Voss et al., 2006; Perlbarg et al., 2009; Tollard et al., 2009; Tshibanda et al., 2009; Fernandez-Espejo et al., 2010, 2011; Newcombe et al., 2010; Edlow et al., 2012). Über die gesamte Rekonstruktion und Schätzung des ARAS im menschlichen Gehirn ist jedoch wenig bekannt (Edlow et al., 2012).
In der aktuellen Studie mit DTI haben wir versucht, die untere Einzelkomponente zu rekonstruieren des ARAS vom Pontin RF zu den intralaminaren Kernen des Thalamus im normalen menschlichen Gehirn.
Materialien und Methoden
Probanden
Sechsundzwanzig normale gesunde Probanden (14 Männer, 12 Frauen; Durchschnittsalter 31,85 ± 9,80 Jahre; Bereich 20–50) ohne neurologische Erkrankung in der Vorgeschichte wurden für diese Studie rekrutiert. Alle Probanden nahmen als Freiwillige an dieser Studie teil und gaben eine schriftliche Einwilligung, bevor sie sich einem DTI-Scan unterzogen. Die Studie wurde vom Institutional Review Board unseres Krankenhauses genehmigt.
Diffusionstensorbild
DTI-Daten wurden mit einer 6-Kanal-Kopfspule auf einem 1,5-T-Philips Gyroscan Intera ( Philips, Best, Niederlande) mit Einzelbild-Echo-Planar-Bildgebung. Für jeden der 32 nicht kollinearen diffusionssensibilisierenden Gradienten wurden 67 zusammenhängende Schnitte parallel zur anterioren Kommissur-posterioren Kommissurlinie aufgenommen. Die Bildgebungsparameter waren wie folgt: Erfassungsmatrix = 96 × 96, rekonstruiert zu Matrix = 128 × 128, Sichtfeld = 221 mm × 221 mm, TR = 10.726 ms, TE = 76 ms, Reduktionsfaktor für parallele Bildgebung (SENSE-Faktor) = 2, EPI-Faktor = 49 und b = 1000 s / mm², NEX = 1 und eine Scheibendicke von 2,3 mm (erfasste isotrope Voxelgröße 2,3 mm × 2,3 mm × 2,3 mm).
Probabilistische Faser Tracking
Die Analyse diffusionsgewichteter Bildgebungsdaten wurde unter Verwendung der Softwarebibliothek des Oxford Centre for Functional Magnetic Resonance Imaging des Gehirns (FMRIB) (FSL; www.fmrib.ox.ac.uk/fsl) durchgeführt. Die affine zweidimensionale Registrierung mit mehreren Maßstäben wurde zur Korrektur des Kopfbewegungseffekts und der Bildverzerrung aufgrund des Wirbelstroms verwendet. Die Faserverfolgung wurde unter Verwendung einer probabilistischen Traktographiemethode durchgeführt, die auf einem Multifasermodell basierte, und in der aktuellen Studie unter Verwendung von in FMRIB-Diffusion implementierten Traktographieroutinen (5000 Stromlinienproben, Schrittlängen von 0,5 mm, Krümmungsschwellen = 0,2) angewendet (Smith et al., 2004) ).Zu den Vorteilen der probabilistischen Traktographie, die in dieser Studie verwendet wurde, gehören eine größere Robustheit gegenüber Rauschen sowie die Fähigkeit, Wege mit schärferen Winkeln zu erkennen und sich kreuzende Fasern zu unterscheiden (Behrens et al., 2007; Winston et al., 2011).
Der Weg des ARAS wurde durch Auswahl von Fasern bestimmt, die durch interessierende Keimregionen (ROI) und Ziel-ROIs (Termination) laufen. Ein Samen-ROI wurde auf der RF der Pons in Höhe der Eintrittszone des Trigeminusnervs platziert (Daube, 1986; Afifi und Bergman, 2005). Eine Analyse des medialen Lemniscus und des Rubrospinaltrakts wurde durchgeführt, um die Grenze der RF auf den Pons zu bestätigen (1A). Zur Analyse des medialen Lemniscus wurden Samen-ROIs auf das anteromediale Medulla und der Ziel-ROI auf den somatosensorischen Kortex gelegt (Hong et al., 2010). Zur Analyse des Rubrospinaltrakts wurden Samen-ROIs auf den roten Kern und der Ziel-ROI auf die kontralaterale dorsolaterale Region des Medulla (Monakow-Gebiet) gelegt (Nathan und Smith, 1982; Kwon et al., 2011). Der Ziel-ROI wurde auf den intralaminaren Kernen des Thalamus in Höhe der Kommissuralebene angegeben (Morel, 2007). Bei der Definition der intralaminaren Kerne des Thalamus haben wir uns auf einen Hirnatlas bezogen (Morel, 2007) (Abbildung 1A). Von 5000 Proben, die aus dem Samenvoxel erzeugt wurden, wurden die Ergebnisse für den Kontakt bei einem Schwellenwert von mindestens 1 sichtbar gemacht, der zur Analyse durch jedes Voxel gestrafft wurde. Die Werte der fraktionellen Anisotropie (FA), der mittleren Diffusionsfähigkeit (MD) und der Traktzahl der unteren Einzelkomponente von ARAS wurden gemessen.
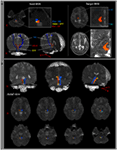
Abbildung 1. (A) Die interessierenden Samenregionen (ROI) sind auf der retikulären Formation des Pontins angegeben (rote Farbe). Der Ziel-ROI wird auf den intralaminaren Kernen des Thalamus in Höhe der Kommissuralebene angegeben. Die Grenze der intralaminaren Kerne des Thalamus wurde unter Bezugnahme auf das Lehrbuch des Gehirnatlas definiert (Morel, 2007). ML, medialer Lemniscus; RST, Rubrospinaltrakt; RF, retikuläre Bildung; AC, vordere Kommissur; PC, hintere Kommissur. (B) Die Wege des rekonstruierten aufsteigenden retikulären Aktivierungssystems sind auf jeder Ebene des Gehirns bei einem normalen Probanden (26-jähriger Mann) gezeigt.
Statistische Analyse
Für die Datenanalyse wurde die SPSS-Software (v.15.0; SPSS, Chicago, IL, USA) verwendet. Der gepaarte t-Test wurde zur Bestimmung der Differenz der Werte der DTI-Parameter des ARAS zwischen der rechten und der linken Hemisphäre verwendet. Der Pearson-Korrelationstest wurde zur Bestimmung der Korrelation zwischen den DTI-Parametern des ARAS und dem Alter verwendet. Die Ergebnisse wurden als signifikant angesehen, wenn der p-Wert < 0,05 war.
Ergebnisse
Wir rekonstruierten die untere Einzelkomponente des ARAS zwischen dem Pontin RF und intralaminare Kerne des Thalamus. Die rekonstruierte Komponente des ARAS stammte aus dem Pontin RF, stieg durch das mesencephale Tegmentum unmittelbar hinter dem roten Kern auf und endete dann bei allen Probanden auf der Höhe der Kommissuralebene auf den intralaminaren Kernen des Thalamus (Abbildung 1B) / p>
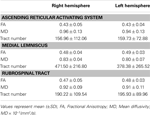
Tabelle 1. Diffusionstensor-Bildgebungsparameter des aufsteigenden retikulären Aktivierungssystems .
Diskussion
In der aktuellen Studie haben wir mithilfe von DTI einen der Hauptpfade von rekonstruiert das ARAS, die untere Einzelkomponente des ARAS von der RF zum Thalamus bei normalen Probanden, obwohl das ARAS aus zusätzlichen Hirnstammkernen, Hypothalamus, basalem Vorderhirn und thalamokortikalen Projektionen zur Großhirnrinde besteht. Wir haben zwei ROIs für die Rekonstruktion der unteren Einzelkomponente des ARAS ausgewählt: den Samen-ROI, der die RF der Pons auf der Ebene der Trigeminus-Nerveneintrittszone war (Daube, 1986; Afifi und Bergman, 2005), und das Ziel ROI, der die intralaminaren Kerne des Thalamus (die zentralen lateralen Kerne, die zentromedianen / parafaszikulären Kerne und die parazentralen Kerne) auf der Ebene der Kommissuralebene umfasste (Morel, 2007). Der rostrale Teil der RF des Hirnstamms oberhalb der Eintrittszone des Trigeminusnervs ist als ARAS bekannt. Im Gegensatz dazu ist der kaudale Teil der RF an der motorischen Funktion und der autonomen Funktion im Zusammenhang mit der Herz- und Atemfunktion beteiligt (Daube, 1986). Daher haben wir den Samen-ROI in der RF in Höhe der Trigeminus-Eintrittszone platziert. Wir platzierten den Ziel-ROI in den intralaminaren Kernen, die die Hauptkerne des ARAS unter den unspezifischen Thalamuskernen sind. Wir glauben daher, dass die untere Einzelkomponente des ARAS, die in der aktuellen Studie rekonstruiert wurde, nicht die gesamte untere Einzelkomponente des ARAS ist, sondern der Hauptteil des ARAS, da wir die anderen mit dem ARAS befassten Thalamuskerne nicht einbeziehen konnten gesamte untere Einzelkomponente des ARAS.Folglich stammte die untere Einzelkomponente des ARAS aus dem Pontin RF, stieg durch das mesencephale Tegmentum hinter dem roten Kern auf und endete dann an den intralaminaren Kernen des Thalamus. Darüber hinaus unterschieden sich die Werte für die FA-, MD- und Traktzahlen der rekonstruierten unteren Einzelkomponente des ARAS zwischen der rechten und der linken Hemisphäre nicht signifikant. Die Traktnummer wird durch die Anzahl der in einem Neuraltrakt enthaltenen Voxel bestimmt (Kwak et al., 2010). Der FA-Wert gibt den Grad der Richtwirkung und Integrität von Mikrostrukturen der weißen Substanz wie Axonen, Myelin und Mikrotubuli an, und der ADC-Wert gibt die Größe der Wasserdiffusion an (Assaf und Pasternak, 2008).
Mehrere Studien haben die klinische Nützlichkeit von DTI durch Schätzung einiger Bereiche der unteren Einzelkomponente des ARAS von der RF bis zum Thalamus bei Patienten mit Bewusstseinsstörungen gezeigt (Perlbarg et al., 2009; Tollard et al., 2009; Newcombe et al., 2010; Fernandez-Espejo et al., 2011). Tollard et al. (2009) berichteten über die Nützlichkeit von DTI, das im subakuten Stadium zur Vorhersage des Ergebnisses bei 45 Patienten mit schwerem TBI (traumatische Hirnverletzung) durchgeführt wurde (keine Reaktion auf einfache Befehle). In ihrer Studie haben sie den FA-Wert in mehreren supratentoriellen und infratentoriellen Bereichen gemessen, einschließlich der vorderen Pons, hinteren Pons und des Mittelhirns, und gezeigt, dass die Abnahme der infratentoriellen und supratentoriellen FA mit Ausnahme der hinteren Pons die Vorhersage ungünstiger Ergebnisse ermöglichte 1 Jahr von TBI. Perlbarg et al. (2009), die DTI-Scans bei 30 Patienten ohne Reaktion auf einfache Befehle nach schwerem TBI durchführten, berichteten über eine deutliche Abnahme der FA, gemessen im unteren Längsfasciculus, Mittelhirn (Hirnstiel und Tegmentum), hintere Extremität der inneren Kapsel und posteriorer Corpus callosum in der ungünstigen Ergebnisgruppe. Newcombe et al. (2010) verwendeten DTI zur Charakterisierung des Ausmaßes und des Ortes des Verlusts der weißen Substanz bei Patienten, die sich in einem vegetativen Zustand nach TBI befanden (sieben Patienten) und bei Patienten mit ischämisch-hypoxischer Verletzung (fünf Patienten). In beiden Gruppen wurden Abnormalitäten in den supratentoriellen Bereichen beobachtet; Im Gegensatz dazu wurden Anomalien des Hirnstamms nur in der TBI-Gruppe beobachtet. Fernandez-Espejo et al. (2011) verwendeten DTI zur Differenzierung der Neuropathologie von 25 vegetativen und minimal bewussten Patienten. Sie kamen zu dem Schluss, dass sich Patienten mit minimalem Bewusstsein und Patienten in einem vegetativen Zustand in subkortikaler weißer Substanz und Thalamusregionen unterschieden, sich jedoch im Hirnstamm nicht zu unterscheiden schienen. In einer kürzlich durchgeführten Studie mit Diffusionsbildgebung mit hoher Winkelauflösung haben Edlow et al. (2012) berichteten über die neuroanatomische Konnektivität des ARAS im menschlichen Gehirn sowohl in vivo als auch ex vivo. Sie zeigten, dass die Konnektivitäten spezifischer ARAS-Kerne an der Erregung und die der Thalamuskerne an der Modulation der Erregung beteiligt waren.
Zusammenfassend rekonstruierten wir mithilfe von DTI die untere Einzelkomponente des ARAS aus dem RF zum Thalamus im menschlichen Gehirn. Wir glauben, dass die verwendete Methodik und die Ergebnisse dieser Studie für Forscher hilfreich sein können, die das ARAS im menschlichen Gehirn untersuchen. Eine der Einschränkungen dieser Studie besteht jedoch darin, dass wir nicht das gesamte ARAS-System vollständig aufklären konnten, da wir keine anderen Thalamus- und Hirnstammkerne in unsere Analyse einbezogen haben, die ebenfalls am ARAS beteiligt sind. Weitere Studien zur klinischen Nützlichkeit unserer Ergebnisse sowie Studien zu den Projektionen des ARAS vom Thalamus zur Großhirnrinde sind erforderlich.
Interessenkonflikterklärung
Die Autoren erklären dass die Untersuchung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Diese Arbeit wurde von der DGIST R & D Programm des koreanischen Ministeriums für Bildung, Wissenschaft und Technologie (13-BD-0401).
Afifi, AK und Bergman, RA (2005). Funktionelle Neuroanatomie: Text und Atlas. New York: Lange Medical Books / McGraw-Hill.
Morel, A. (2007). Stereotaktischer Atlas des menschlichen Thalamus und der Basalganglien. New York: Informa Healthcare.