Eine C57BL / 6-Maus gibt es nicht!
Es ist wichtig, dass Sie wissen, welchen spezifischen C57BL / 6-Substrain Sie verwenden, damit Sie die entsprechenden Steuerelemente für Ihre Experimente verwenden und Ihre Daten korrekt interpretieren können! Seit C.C. Little (der Gründer des Jackson Laboratory) erzeugte in den 1920er und 1930er Jahren zunächst den Inzuchtstamm C57BL. Der Inzuchtstamm C57BL / 6 wurde zum am häufigsten verwendeten Mausstamm in der biomedizinischen Forschung. Die Popularität von C57BL / 6-Inzuchtmäusen führte zur Gründung vieler Kolonien bei verschiedenen Anbietern und akademischen Institutionen auf der ganzen Welt.
C57BL / 6-Substämme
Sie wissen dies möglicherweise nicht: alle Wenn eine neue C57BL / 6-Kolonie 20 oder mehr Generationen lang getrennt von einer bestehenden Kolonie unterhalten wird, wird sie zu einer neuen C57BL / 6-Substrain. Die Generationen sind kumulativ. Wenn also jede der beiden getrennten Kolonien 10 Generationen (~ 2-3 Jahre) brütet, sind sie 20 Generationen voneinander entfernt und verschiedene Substrains mit möglicherweise unterschiedlichen Phänotypen. Als Teil der Nomenklatur eines Stammes werden am Ende Laborcodes als Substrain-Bezeichnung hinzugefügt. C57BL / 6J ist die elterliche Substrain; „J“ ist der Laborcode für das Jackson Laboratory. Daher gibt es keine Quelle für „C57BL / 6“ -Mäuse; Für jeden Substrain gibt es immer eine längere Bezeichnung, die das Institut oder Labor angibt, in dem die verschiedenen Kolonien unterhalten werden.
C57BL / 6-Substrains sind nicht gleich!
Einmal ein neuer C57BL / 6-Substrain Wenn festgestellt wird, treten spontane Mutationen sowohl in der ursprünglichen als auch in der neuen Kolonie auf. Eine Untergruppe dieser Mutationen breitet sich durch genetische Drift in der Kolonie aus und wird fixiert (bei allen Mäusen homozygot). Je länger einzelne Substrains voneinander getrennt sind, desto größer sind die genetischen Unterschiede zwischen ihnen. Diese genetischen Unterschiede können zu phänotypischen Unterschieden führen.
C57BL / 6J vs. C57BL / 6N
1951 wurden C57BL / 6J-Mäuse an die National Institutes of Health (NIH) geschickt, wo Eine Kolonie wurde gegründet und hieß C57BL / 6N. Anschließend wurden viele Substämme aus der C57BL / 6N-Kolonie abgeleitet. Es wurde festgestellt, dass eine Mutation, die eine fleckige Netzhautdegeneration verursacht, bekannt als Crb1rd8, in allen C57BL / 6N-verwandten Substrains homozygot ist, im C57BL / 6J-Substrain jedoch nicht vorhanden ist. Darüber hinaus haben Daten, die von den Phänotypisierungszentren des International Knockout Mouse Consortium (IKMC) gesammelt wurden, zahlreiche phänotypische Unterschiede zwischen den C57BL / 6J- und C57BL / 6N-Substrains festgestellt.
Die Gefahren, in die Unwissenheitsfalle zu geraten
Es kann schwerwiegende Folgen haben, wenn Sie den genetischen Hintergrund (Stamm und Substrain) oder Ihre experimentellen Mäuse nicht vollständig kennen. Sie wären nicht der erste Forscher, der in diese Falle gerät. Wenn Sie den falschen Kontrollstamm wählen, besteht ein hohes Risiko, dass Sie Ihre Daten falsch interpretieren, zu fehlerhaften Schlussfolgerungen gelangen und Ihr Forschungsprogramm ernsthaft verzögern.
In unserem Blogbeitrag „Warum es 2 Jahre gedauert hat, bis ein Harvard-Forschungslabor wieder zur Forschung zurückgekehrt ist“ wird beschrieben, wie ein Forschungslabor versehentlich einen Phänotyp der Immunschwäche mit einem Knockout-Allel in Verbindung gebracht hat, obwohl dies tatsächlich fällig war Bei einer Mutation in dem bestimmten C57BL / 6-Substrain wurde das Knockout rückgekreuzt. Der Fehler wurde entdeckt, als das Knockout-Modell von einem anderen Hersteller auf ein C57BL / 6-Substrain zurückgekreuzt wurde und der Phänotyp verloren ging. und Ressourcen, die verwendet wurden, um zu klären, warum das Team frühere Ergebnisse nicht replizieren konnte, hätten eingespart werden können, wenn die Autoren Kontrollmäuse mit demselben genetischen Hintergrund verwendet hätten – derjenige, der zur Rückkreuzung des interessierenden Knockout-Modells verwendet wurde.
Ist dieses Gen schützend oder toxisch?
Ein weiteres bemerkenswertes Beispiel stammt aus einem Labor des National Heart, Lung und Blood Institute (Teil von NIH). Nach dem Testen der Auswirkungen eines Mapk9 (Jnk2) -Knockouts auf Paracetamol -induzierte Leberschädigung unter Verwendung von C57BL / 6J als Wildtyp-Kontrollen Die Ergebnisse entsprachen den Erwartungen. Bei wiederholter Verwendung von C57BL / 6NJ (C57BL / 6N, das 2005 von NIH in JAX importiert wurde) als Wildtyp-Kontrolle fiel der Phänotyp der Mapk9-Knockouts genau zwischen den Phänotyp für C57BL / 6J und C57BL / 6NJ (siehe Abbildung).
Die Forscher befanden sich in einer Situation, in der sie ihre Daten je nach verwendeter Kontrolle auf zwei entgegengesetzte Arten interpretieren konnten. Wenn das C57BL / 6J als Kontrolle verwendet wurde, zeigten die Daten, dass MAPk9 hepatoprotektiv war. Wenn sie C57BL / 6NJ als Kontrollen verwendeten, schien MAPK9 hepatotoxisch zu sein.
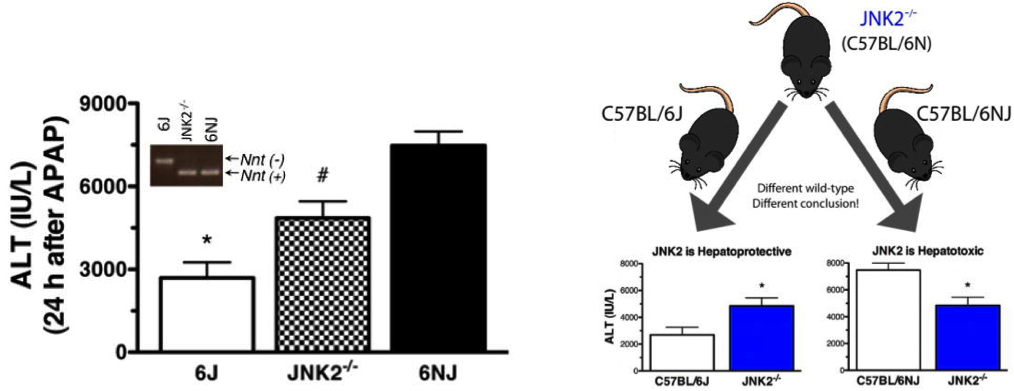
Abbildung 1. Datenschlussfolgerungen unterscheiden sich je nach Auswahl des Kontrollstamms. Die Mäuse wurden mit Paracetamol (APAP, 300 mg / kg intraperitoneal) behandelt. Die Leberschädigung wurde 24 Stunden nach der Behandlung durch Messung der Serum-Alanin-Aminotransferase (ALT) -Aktivität bewertet.
Glücklicherweise konnten die Forscher feststellen, dass sich das Mapk9-Knockout auf einem C57BL / 6N-Hintergrund befand, und kamen zu dem Schluss, dass die Gen war hepatotoxisch.Überlegen Sie jedoch, wie leicht diese Daten falsch interpretiert werden könnten und wie oft solche Fehler vollständig übersehen werden, was zu nicht reproduzierbaren Ergebnissen führt!
Seien Sie daher gewarnt und stellen Sie sicher, dass Sie nicht nur den Inzuchtstamm kennen, sondern auch die Substrain von Mäusen, die Sie für Experimente verwenden, damit Sie die richtigen Kontrollen auswählen und zuverlässige aussagekräftige Daten erstellen. Denken Sie daran, es gibt keinen C57BL / 6-Mausstamm, es gibt immer einen längeren Namen!