Der tragbare Kardioverter-Defibrillator: Ein Leben (Weste) der Kontroverse

Die USA Die Food and Drug Administration (FDA) genehmigte 2001 ein Medizinprodukt, nachdem ihre zentrale klinische Studie Sicherheit und Wirksamkeit bei fünf von sieben Patienten gezeigt hatte, die eine Behandlung erhielten.1 Über ein Jahrzehnt lang wurden in realen Beobachtungsstudien mit dem beschriebenen Medizinprodukt unterschiedliche Unterschiede festgestellt Interpretationen des Nutzens.
Im Jahr 2018, 17 Jahre nach der Zulassung durch die FDA, zeigten die Ergebnisse der ersten randomisierten kontrollierten Studie mit dem Medizinprodukt negative Ergebnisse.2 Bis heute wird dieses Medizinprodukt weiterhin verschrieben, und In bestimmten Einrichtungen ist dies zum Standard der Pflege geworden. Dies ist die Geschichte des LifeVest®, des einzigen von der FDA zugelassenen tragbaren Kardioverter-Defibrillators (WCD), der das Risiko eines plötzlichen Herztodes (SCD) bei Patienten mit reduzierter linksventrikulärer Ejektionsfraktion (LVEF), die einen akuten Myokardinfarkt erlitten haben, verringert (AMI).
Die Rolle eines ICD bei Patienten mit einem LVEF ≤ 35-40% unmittelbar nach AMI wurde bereits in zwei randomisierten kontrollierten Studien (DINAMIT und IRIS) untersucht. 4 In DINAMIT war die SCD-Rate bei Patienten mit randomisiertem ICD signifikant niedriger als ohne ICD (4% gegenüber 8%; p = 0,009), in der ICD-Gruppe war die Rate der Todesfälle ohne SCD jedoch signifikant höher als in der Gruppe ohne ICD (15% gegenüber 9%; p = 0,02). In ähnlicher Weise gab es bei IRIS eine signifikant niedrigere SCD-Rate bei Patienten, die zu ICD randomisiert wurden, als bei keinem ICD (6% gegenüber 13%; p = 0,049), aber es gab eine signifikant höhere Rate von Nicht-SCD-Todesfällen in der ICD-Gruppe als in der Gruppe ohne ICD (15% gegenüber 9%; p = 0,001).
Obwohl ICDs in diesen randomisierten Studien mit einem geringeren SCD-Risiko assoziiert waren, wurde dies durch die Assoziation mit einem hohen Risiko ausgeglichen von Nicht-SCD-Ereignissen. Infolgedessen empfehlen die aktuellen Richtlinien des ACC / AHA / HRS eine ICD-Implantation zur Primärprävention von SCD in dieser Population nach einer 40-tägigen richtliniengesteuerten medizinischen Therapie (oder einer 90-tägigen richtliniengesteuerten medizinischen Therapie, wenn eine Revaskularisierung vorliegt durchgeführt) (Abbildung 1) .5
Abbildung 1: Primärprävention von SCD bei Patienten mit ischämischer Herzkrankheit
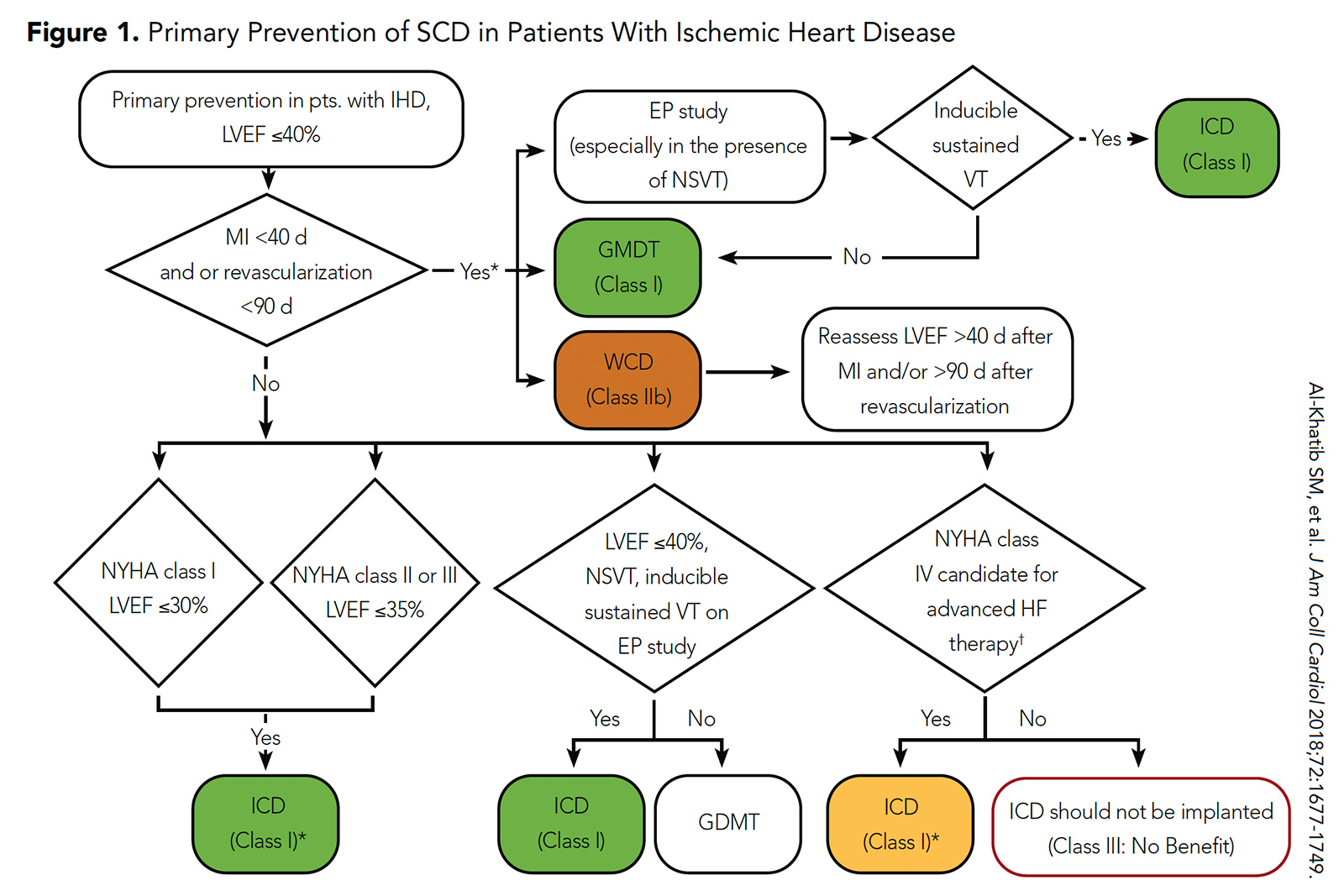 Klicken Sie auf das Bild oben, um es zu vergrößern.
Klicken Sie auf das Bild oben, um es zu vergrößern. Abbildung 2: ACC / AHA / HRS-Richtlinie 2017 für die Verwendung von tragbaren Kardioverter-Defibrillatoren
 Klicken Sie auf das Bild oben, um eine größere Ansicht zu erhalten.
Klicken Sie auf das Bild oben, um eine größere Ansicht zu erhalten.
Das SCD-Risiko unmittelbar nach der AMI ist jedoch in den ersten 30 Tagen am höchsten. Die VALIANT-Studie umfasste 14.609 Patienten mit einem LVEF ≤ 40% nach AMI und zeigte, dass 7% der Patienten über einen Zeitraum von zwei Jahren einen plötzlichen Tod oder Herzstillstand erlebten. Alarmierende 19% dieser Todesfälle traten in den ersten 30 Tagen nach AMI auf, und das Risiko war bei Patienten mit einem LVEF ≤ 30% (2,3% pro Monat) am höchsten .6
Zusammen mit den Ergebnissen von DINAMIT und IRIS, die Ergebnisse von VALIANT, zeigten die Notwendigkeit einer Nicht-ICD-Strategie zum Schutz der Patienten vor dem Auftreten von SCD. Die WCD, die zum Zeitpunkt dieser Versuche bereits von der FDA zugelassen war, schien die perfekte Lösung zu sein.
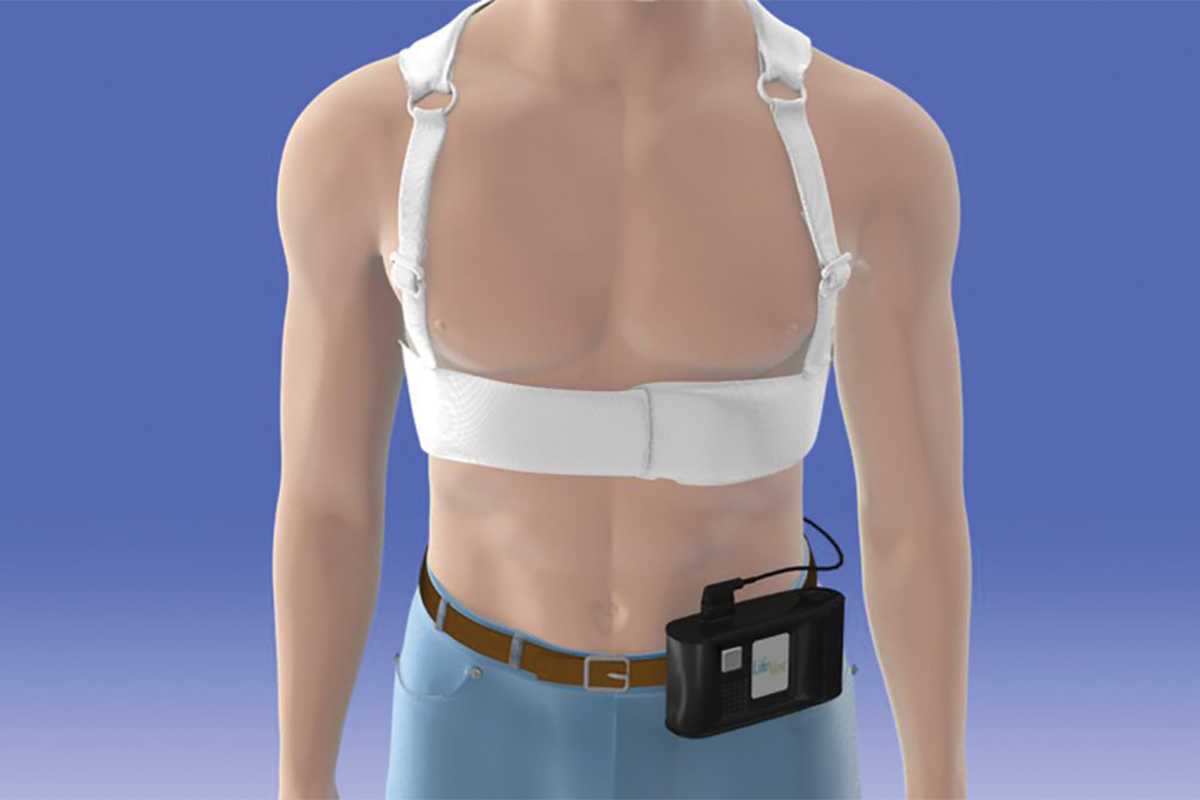
Die derzeit verfügbare Version der WCD ist die LifeVest von Zoll Medical Corporation.7 Das Gerät besteht aus a Brustkleidungsstück mit zwei vertikal entlang des Rückens angeordneten Defibrillator-Pads, einem Frontgürtel mit einem horizontal positionierten Defibrillator-Pad mit Elektroden, die den Herzrhythmus erfassen, und einer kleinen Monitorbox, die den Rhythmus aufzeichnet und die Batterie enthält. Nach der Aktivierung kann die LifeVest dem Patienten drei mögliche Alarme zur Verfügung stellen: Ein Gong-Alarm, der anzeigt, dass die Monitorbox beachtet werden muss; ein Vibrationsalarm, der anzeigt, dass eine tödliche Arrhythmie festgestellt wurde und dass die WCD-Behandlungssequenz aktiviert wird; und ein Sirenenalarm, der einen Schock anzeigt, steht unmittelbar bevor. Unmittelbar vor der Abgabe des Schocks wird ein blaues Gel von den drei Defibrillationskissen auf den Patienten freigesetzt, um den Kontakt für die elektrische Leitung zu verbessern. Der Schockvektor befindet sich zwischen den Defibrillator-Pads auf der Rückseite und dem Defibrillator-Pad im Frontalgürtel.
Die realen Erfahrungen mit der WCD wurden in zahlreichen Studien beschrieben, die von 2001 bis 2018 veröffentlicht wurden Zu den größten untersuchten Patientenkohorten gehörten 8.453 Patienten aus dem Zoll-Register. Insgesamt erhielten 133 Patienten (1,6%) 309 geeignete Schocks, wobei 91% der Schocks den Patienten erfolgreich von einer ventrikulären Tachyarrhythmie wiederbelebten (84% bei nichtrevaskularisierten Patienten und 95% bei revaskularisierten Patienten). Die mediane Zeit von AMI bis zum Schock betrug 16 Tage, und 75% der Schocks traten im Monat nach AMI auf.8
Die lang erwartete VEST-Studie wurde vom Hauptautor als späte klinische Studie vorgestellt Jeffrey E. Olgin, MD, FACC, bei ACC.18 und schließlich im New England Journal of Medicine veröffentlicht.Das Ziel der VEST-Studie war es, die Wirksamkeit der WCD während des Zeitraums zu bestimmen, bevor ICDs bei Patienten mit einem MI und einem reduzierten LVEF angezeigt sind. Über einen Zeitraum von fast zehn Jahren wurden 2.302 Patienten mit AMI und einem LVEF ≤ 35% im Verhältnis 2: 1 zu WCD vs. ohne WCD randomisiert. Die Analyse wurde in einer Intention-to-Treat-Weise durchgeführt.
Die Ergebnisse von VEST waren bemerkenswert für keinen signifikanten Unterschied im primären zusammengesetzten Ergebnis eines plötzlichen Todes oder Todes durch ventrikuläre Tachykardie oder Kammerflimmern nach 90 Tagen (arrhythmisch) Tod), der bei 1,6% der Patienten in der WCD-Gruppe und bei 2,4% der Patienten in der Nicht-WCD-Gruppe auftrat (relatives Risiko 0,66; 95% -Konfidenzintervall 0,37-121; p = 0,18)
Insbesondere 43 Patienten (2,8%) in der WCD-Gruppe trugen nie ein Gerät, und 20 Patienten (2,6%) in der Nicht-WCD-Gruppe erhielten das Gerät außerhalb der Studie. 10 Patienten in der WCD-Gruppe (0,7%) und 15 Patienten in der Nicht-WCD-Gruppe (1,5%) gingen für die Nachsorge verloren, und zwei Patienten in jeder Gruppe (insgesamt 5%) hatten nicht genügend Daten, um die Ursache des plötzlichen Auftretens zu bestimmen Tod. Die Autoren äußerten Bedenken, dass die Nichteinhaltung des Tragens der WCD in der WCD-Gruppe die Leistung der Studie verringert haben könnte, da die erwartete WCD-Tragezeit von 70% erst in den ersten zwei Wochen der Studie erreicht wurde. Letztendlich wurde die VEST-Studie als negative Studie für die Fähigkeit der WCD angesehen, das SCD-Risiko in ihrer Zielpopulation signifikant zu verringern.2
Die negativen Ergebnisse schienen jedoch nicht von der Verwendung von WCD abzuraten und ermutigte stattdessen die Forscher, ihre Ergebnisse in Frage zu stellen. Die größte verfügbare Metaanalyse von 28 Studien mit 33.242 Patienten (einschließlich des interventionellen Arms der VEST-Studie) von 2001 bis 2018 ergab, dass geeignete WCD-Behandlungen, geeignete WCD-Schocks und unangemessene WCD-Schocks mit einer Rate von 7/100 Personen auftraten 5/100-Personen bzw. 2/100-Personen über einen Zeitraum von drei Monaten.
In dieser Metaanalyse traten bei Patienten mit ischämischer Kardiomyopathie, nichtischämischer Kardiomyopathie und gemischter Kardiomyopathie geeignete WCD auf Behandlungen mit einer Rate von 8/100-Personen, 6/100-Personen bzw. 3/100-Personen über einen Zeitraum von drei Monaten. Im Vergleich zu Patienten mit ischämischer Kardiomyopathie bei VEST zeigten Patienten mit ischämischer Kardiomyopathie in der Nicht-VEST-Kohorte eine höhere Inzidenz einer geeigneten WCD-Therapie (11/100-Personen gegenüber 1/100-Personen über drei Monate). Bei der Untersuchung des Musters der Verschreibung von WCD machten die Autoren die interessante Beobachtung, dass die fortgesetzte Verwendung von WCD „wahrscheinlich von der Endgültigkeit der SCD und teilweise von der Angst vor Rechtsstreitigkeiten getrieben wird, obwohl keine Daten vorliegen, die dies belegen“. 9
Die zweite dieser Studien untersuchte die Mortalität und die Kosten im Zusammenhang mit der Verwendung von WCD bei 16.935 Patienten anhand von Medicare-Angaben. Die Verwendung von WCD war mit einer signifikanten Verringerung der einjährigen Mortalität nach AMI verbunden (19,8% gegenüber 11,5%; p = 0,017), und diese Verringerung der absoluten Mortalität um 8,3% entsprach einem inkrementellen Kosten-Nutzen-Verhältnis (ICER) von 12.373,11 USD Mit anderen Worten, die Nutzung der WCD kostet 12.373 USD, um im ersten Jahr nach AMI ein Leben zu retten. Gemäß der ACC / AHA-Erklärung zur Kosten- / Wertmethodik in Richtlinien und Leistungsmaßstäben für die klinische Praxis würde die ICER für die WCD als eine Ressource mit hohem Wert eingestuft (ICER 12
, obwohl der Weg für die Akzeptanz der WCD hat Umständlich war, hat es sich seinen Platz in der kurzen Liste der modernen, lebensrettenden Medizinprodukte verdient. Dementsprechend hat in der jüngsten ACC / AHA / HRS-Richtlinie von 2017 die Verwendung einer WCD nach AMI bei Patienten mit einem LVEF ≤ 35% wurde eine IIb-Empfehlung gegeben (Abbildung 2) .5
Wie alle Therapien ist die WCD am effektivsten, wenn sie wie vorgeschrieben angewendet wird. Dies erfordert jedoch eine kontinuierliche Einhaltung für bis zu 90 Tage sowie ständige Aufmerksamkeit für die verschiedenen Gerätealarme, die zu einem bestimmten Zeitpunkt aktiviert werden können. Es werden Entwicklungen durchgeführt, um die Kleidungsstücke, Monitore und die allgemeine Patientenerfahrung zu verbessern. Die Einhaltung wird jedoch wahrscheinlich die Patientenpopulation einschränken, die tatsächlich von diesem umständlichen Gerät profitieren wird. In der Zwischenzeit bleibt es aktiv t o Der Kardiologe entscheidet, welche Patienten am besten geeignet sind, um die LifeVest nicht nur zu erhalten, sondern auch zu tragen.

Dieser Artikel wurde von Edward Chu, MD, (@Ed_Chu_MD), Elektrophysiologie-Fellow in Training (FIT) am Mount Sinai Medical Center in New York, verfasst.
- Feldman AM, Klein H., Tchou P. et al. WEARIT-Ermittler und -Koordinatoren; BIROAD Ermittler und Koordinatoren. Verwendung eines tragbaren Defibrillators zur Beendigung von Tachyarrhythmien bei Patienten mit hohem Risiko für plötzlichen Tod: Ergebnisse des WEARIT / BIROAD. Pacing Clin Electrophysiol 2004; 27 (1): 4-9. Olgin JE, Pletcher MJ, Vittinghoff E, et al. VEST-Ermittler. Tragbarer Kardioverter-Defibrillator nach Myokardinfarkt.N Engl J Med 2018; 379: 1205–15. Hohnloser SH, Kuck KH, Dorian P, et al.; DINAMIT-Ermittler. Prophylaktische Anwendung eines implantierbaren Kardioverter-Defibrillators nach akutem Myokardinfarkt. N Engl J Med 2004; 351: 2481–8. Steinbeck G., Andresen D., Seidl K. et al.; IRIS-Ermittler. Defibrillatorimplantation früh nach Myokardinfarkt. N Engl J Med 2009; 361: 1427–36. Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA / ACC / HRS-Richtlinie für die Behandlung von Patienten mit ventrikulären Arrhythmien und die Prävention des plötzlichen Herztodes: Zusammenfassung: Ein Bericht der Task Force des American College of Cardiology / American Heart Association zu Richtlinien für die klinische Praxis und der Heart Rhythm Society. J. Am. Coll. Cardiol. 2018; 72: 1677–1749. Solomon SD, Zelenkofske S., McMurray J. J., et al. Valsartan in der Studie zum akuten Myokardinfarkt (VALIANT). Plötzlicher Tod bei Patienten mit Myokardinfarkt und linksventrikulärer Dysfunktion, Herzinsuffizienz oder beidem. N Engl J Med 2005; 352: 2581-8.
- Zoll LifeVest. Zoll Medical Corporation. Hier verfügbar Zugriff am 13. September 2020.
- Epstein AE, Abraham WT, Bianco NR, et al. Tragbarer Kardioverter-Defibrillator bei Patienten, bei denen ein hohes Risiko für einen frühen post-myokardialen Infarkt besteht. J Am Coll Cardiol 2013; 62: 2000-7. Masri A., Altibi AM, Erqou S. et al. Tragbare Kardioverter-Defibrillator-Therapie zur Verhinderung eines plötzlichen Herztodes: Eine systematische Überprüfung und Metaanalyse. JACC Clin Electrophysiol 2019; 5: 152-61. Olgin JE, Lee BK, Vittinghoff E. et al. Einfluss der Einhaltung tragbarer Kardioverter-Defibrillatoren auf die Ergebnisse der VEST-Studie: Analysen im behandelten Zustand und nach Protokoll. J Cardiovasc Electrophysiol 2020; 31: 1009-18.
- Clark MA, Szymkiewicz SJ, Volosin K. Mortalität und Kosten im Zusammenhang mit tragbaren Kardioverter-Defibrillatoren nach akutem Myokardinfarkt: Eine retrospektive Kohortenanalyse von Daten zu Arzneimittelansprüchen. J Innov Card Rhythm Manag 2019; 10: 3866-73. Anderson JL, PA Heidenreich, PG Barnett et al.; ACC / AHA Task Force für Leistungsmessungen; ACC / AHA Task Force für Praxisrichtlinien. ACC / AHA-Erklärung zur Kosten-Wert-Methodik in Leitlinien und Leistungsmaßstäben für die klinische Praxis: Ein Bericht der Task Force des American College of Cardiology / der American Heart Association zu Leistungsmaßstäben und der Task Force zu Leitlinien für die Praxis. J Am Coll Cardiol 2014; 63: 2304-22.
Klinische Themen: Arrhythmien und klinisches EP, SCD / ventrikuläre Arrhythmien
Schlüsselwörter: ACC-Veröffentlichungen, Cardiology Magazine, US-amerikanische Food and Drug Administration, Gerätezulassung, Kammerflimmern, Inzidenz, Schlaganfallvolumen, Risiko, Konfidenzintervalle, Medicare, Kosten – Nutzenanalyse, Vibration, Follow-up-Studien, Ziele, Behandlungsabsicht, Verlust der Follow-up, Pflegestandard
< Zurück zu den Auflistungen