12.2: Mole Ratios (Čeština)
Mole Ratios
Problémy se stechiometrií lze charakterizovat dvěma věcmi: (1) informacemi uvedenými v problému a (2) informace, které mají být vyřešeny, označované jako neznámé. Uvedené i neznámé mohou být jak reaktanty, tak produkty, nebo jeden může být reaktant, zatímco druhý je produkt. Množství látek lze vyjádřit v molech. V laboratorní situaci je však běžné určit množství látky na základě zjištění její hmotnosti v gramech. Množství plynné látky lze vyjádřit jejím objemem. V této koncepci se zaměříme na typ problému, kde jsou dané i neznámé množství vyjádřeny v molech.

Chemické rovnice vyjadřují množství reaktantů a produktů v reaktanty a produkty v reakci. Koeficienty vyvážené rovnice mohou představovat buď počet molekul, nebo počet molů každé látky. Výroba amoniaku \ (\ left (\ ce {NH_3} \ right) \) z dusíku a vodíkových plynů je podle německého chemika Fritze Habera důležitou průmyslovou reakcí zvanou Haberův proces.
\
Vyváženou rovnici lze analyzovat několika způsoby, jak ukazuje následující obrázek.
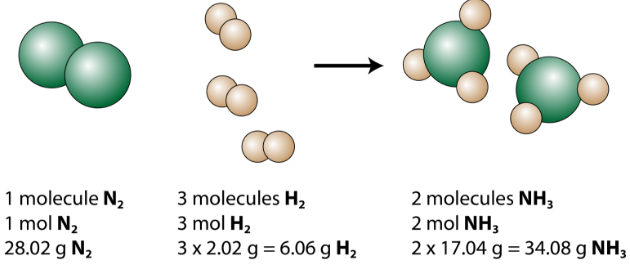
Vidíme, že 1 molekula dusíku reaguje se 3 molekulami vodíku za vzniku 2 molekul amoniaku. Toto je nejmenší možné relativní množství reaktantů a produktů. Pro zvážení větších relativních částek lze každý koeficient vynásobit stejným číslem. Například 10 molekul dusíku by reagovalo s 30 molekulami vodíku za vzniku 20 molekul amoniaku.
Nejužitečnějším množstvím pro počítání částic je mol. Takže pokud je každý koeficient vynásoben molem, vyvážená chemická rovnice nám říká, že 1 mol dusíku reaguje se 3 moly vodíku za vzniku 2 molů amoniaku. Toto je běžný způsob interpretace jakékoli vyvážené chemické rovnice.
\
Při jakékoli chemické reakci musí být zachována hmotnost a počet atomů. Počet molekul nemusí být nutně zachován.

Molární poměr je přepočítací faktor, který spojuje množství v molech libovolných dvou látek v chemické reakci. Čísla v konverzním faktoru pocházejí z koeficientů vyvážené chemické rovnice. Pro výše uvedenou reakci na amoniak lze zapsat následujících šest molárních poměrů.
V problému s molárním poměrem je daná látka vyjádřená v molech zapsána jako první. Vhodný převodní faktor je zvolen za účelem převodu z molů dané látky na moly neznámých.