9.9 Eine Einführung in die organische Synthese
Ziel
Nach Abschluss dieses Abschnitts sollten Sie in der Lage sein, eine mehrstufige Synthese zu entwerfen Um ein bestimmtes Produkt aus einem bestimmten Ausgangsmaterial herzustellen, verwenden Sie eine der bis zu diesem Punkt im Lehrbuch eingeführten Reaktionen.
Studiennotizen
Sie sollten haben festgestellt, dass einige der zugewiesenen Probleme erfordern, dass Sie eine Reihe von organischen Reaktionen aneinander reihen, um eine organische Verbindung in eine andere umzuwandeln, wenn es keine einzige Reaktion gibt, um dieses Ziel zu erreichen. Eine solche Reihe von Reaktionen wird als „organische Synthese“ bezeichnet. Eines der Hauptziele dieses Kurses ist es, Sie beim Entwerfen solcher Synthesen zu unterstützen. Um dieses Ziel zu erreichen, müssen Sie alle im Kurs beschriebenen Reaktionen in Ihrem Gedächtnis haben. Sie müssen einige Reaktionen viel häufiger abrufen als die anderen, und der einzige Weg, um dieses Ziel zu erreichen, ist das Üben. Die Beispiele in diesem Kapitel werden relativ einfach sein, aber Sie werden bald sehen, dass Sie einige ziemlich ausgefeilte Synthesen mit einer begrenzten Anzahl grundlegender Reaktionen entwickeln können.
Das Studium der organischen Chemie setzt einen Studenten einer Vielzahl von miteinander verbundenen Reaktionen aus. Alkene können beispielsweise in strukturell ähnliche Alkane, Alkohole, Alkylhalogenide, Epoxide, Glykole und Borane umgewandelt werden, an die gespalten wird kleinere Aldehyde, Ketone und Carbonsäuren und vergrößert durch Carbokation und Radikaladditionen sowie Cycloadditionen. Alle diese Produkte können anschließend in eine Vielzahl neuer Verbindungen umgewandelt werden, die eine große Vielfalt enthalten der funktionellen Gruppen und damit offen für weitere Ausarbeitungen. Folglich wird die logische Konzeption einer mehrstufigen Synthese zum Aufbau einer bestimmten Verbindung aus einem bestimmten Ausgangsmaterial zu einem der schwierigsten Probleme, die auftreten können.
Eine ein- oder zweistufige Folge einfacher Reaktionen ist nicht so schwer abzuleiten. Wenn man beispielsweise aufgefordert wird, Meso-3,4-hexandiol aus 3-Hexin herzustellen, erkennen die meisten Studenten, dass es notwendig sein wird, das Alkin vor der Glykolbildung zu cis oder trans-3-Hexen zu reduzieren. Die Permanaganat- oder Osmiumtetroxidhydroxylierung von cis-3-Hexen würde das gewünschte Mesoisomer bilden. Aus trans-3-Hexen müsste zuerst das Alken mit einer Persäure epoxidiert werden, gefolgt von einer Ringöffnung mit einem Hydroxidion. Dieses Beispiel zeigt ein gemeinsames Merkmal der Synthese: Oft gibt es mehr als ein wirksames Verfahren, das zum gewünschten Produkt führt.
Längere mehrstufige Synthesen erfordern eine sorgfältige Analyse und Überlegung, da viele Optionen in Betracht gezogen werden müssen. Wie ein erfahrener Schachspieler, der die Vor- und Nachteile potenzieller Züge auf lange Sicht bewertet, muss der Chemiker den potenziellen Erfolg verschiedener möglicher Reaktionspfade bewerten und sich dabei auf den Umfang und die Einschränkungen konzentrieren, die jede der einzelnen verwendeten Reaktionen einschränken. Dies kann eine entmutigende Aufgabe sein, deren Fähigkeiten durch Erfahrung und häufig durch Ausprobieren erworben wurden.
Die drei unten gezeigten Beispiele dienen der Veranschaulichung. Das erste ist ein einfaches Problem bei der Konvertierung funktionaler Gruppen, das zunächst schwierig erscheinen kann. Es ist oft hilfreich, solche Probleme ausgehend vom Produkt rückwärts zu bearbeiten. In diesem Fall sollte es offensichtlich sein, dass Cyclohexanolon durch Cyclohexanol ersetzt werden kann, da letzteres dann durch einfache Oxidation hergestellt werden könnte. Da Cyclohexan (und Alkane im Allgemeinen) relativ unreaktiv sind, scheint die Bromierung (oder Chlorierung) ein offensichtlicher erster Schritt zu sein. Zu diesem Zeitpunkt ist man versucht, Bromcyclohexan durch eine SN2-Reaktion mit Hydroxidionen in Cyclohexanol umzuwandeln. Diese Reaktion würde zweifellos von einer E2-Eliminierung begleitet sein, so dass es sauberer wäre, wenn auch einen Schritt länger, zuerst Cyclohexen herzustellen und es dann mit einer von mehreren Methoden (z. B. Oxymercuration und Hydroboration) zu hydratisieren, einschließlich der durch Klicken auf das Diagramm 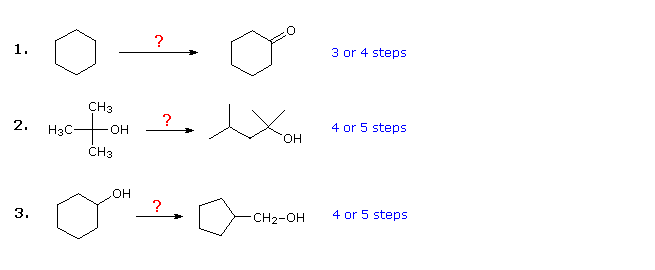 Antwort
Antwort
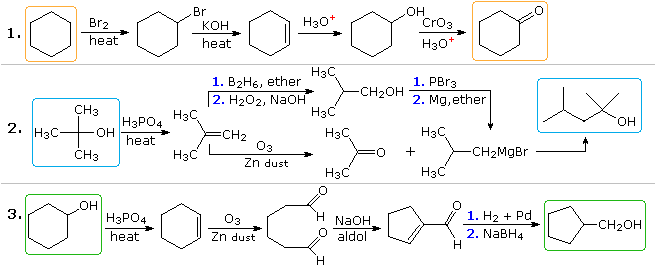
Plausible Lösungen für das zweite und dritte Problem werden ebenfalls oben angezeigt an dieser Stelle. In Aufgabe 2 hat das gewünschte Produkt sieben Kohlenstoffatome und das Ausgangsmaterial vier. Es ist klar, dass zwei von der Ausgangsverbindung abgeleitete Zwischenprodukte miteinander verbunden werden müssen und ein Kohlenstoff entweder vor oder nach dieser Bindung verloren gehen muss. Die 3º-Alkoholfunktion in dem Produkt deutet auf die Bildung durch eine Grignard-Addition an ein Keton hin, und Isobuten scheint, wie gezeigt, ein guter Vorläufer für jeden dieser Reaktanten zu sein. Die Reaktanten- und Produktverbindungen im dritten Problem sind Isomere, aber für diese Strukturänderung ist eindeutig eine Art Bindungsbruch- und Bindungsbildungssequenz erforderlich. Ein mögliches Verfahren ist oben gezeigt. Eine säurekatalysierte Umlagerung von Cyclohexenoxid mit anschließender Reduktion könnte ebenfalls hilfreich sein.
Der nützliche Ansatz, Synthesen ausgehend vom Zielmolekül und rückwärts hin zu einfacheren Ausgangsmaterialien zu erarbeiten, wurde von Prof. E. J. Corey (Harvard) formalisiert und als retrosynthetische Analyse bezeichnet. Bei diesem Verfahren wird das Zielmolekül schrittweise in einfachere Strukturen umgewandelt, indem ausgewählte Kohlenstoff-Kohlenstoff-Bindungen getrennt werden. Diese Trennungen beruhen auf Transformationen, die das Gegenteil von plausiblen synthetischen Konstruktionen sind. Jede so erzeugte einfachere Struktur wird zum Ausgangspunkt für weitere Trennungen, was zu einer verzweigten Menge miteinander verbundener Zwischenprodukte führt. Eine retrosynthetische Transformation wird durch das Symbol = > dargestellt, wie unten für die vorherigen Beispiele gezeigt. 2 & 3. Sobald eine vollständige Analyse durchgeführt wurde Die gewünschte Synthese kann durch Anwendung der den Transformationen zugrunde liegenden Reaktionen durchgeführt werden.
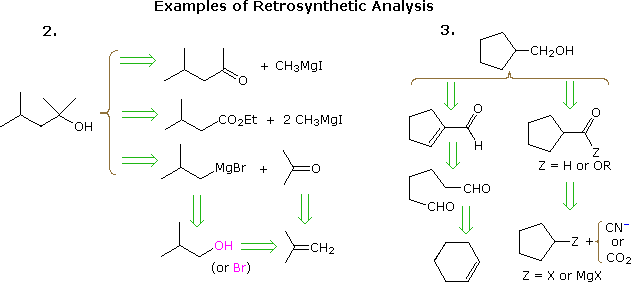
Das obige Diagramm liefert keinen vollständigen Satz von Transformationen für diese Ziele Verbindungen. Wenn ein Ausgangsmaterial wie in den obigen Problemen angegeben wird, müssen die vorgeschlagenen Wege diese Einschränkung widerspiegeln. Somit passen die 4-Methyl-2-pentanon- und 3-Methylbutyratester-Optionen in Beispiel 2, obwohl sie völlig vernünftig sind, nicht gut zu einem tert-Butanol-Start. Ebenso könnte ein Cyclopentyl-Zwischenprodukt einen hervorragenden Weg zum Produkt in Beispiel 3 darstellen, erfüllt jedoch nicht die angegebenen Bedingungen des Problems. Die retrosynthetische Analyse ist besonders nützlich, wenn relativ komplexe Moleküle ohne Einschränkungen des Ausgangsmaterials betrachtet werden. Wenn es ohne Vorurteile durchgeführt wird, treten manchmal ungewöhnliche und faszinierende Möglichkeiten auf. Leider führt die molekulare Komplexität (bestehend aus Größe, Funktionalität, Einbau von Heteroatomen, zyklischer Konnektivität und Stereoisomerie) im Allgemeinen zu sehr großen und stark verzweigten Transformationsbäumen. Computergestützte Analysen haben sich als hilfreich erwiesen, aber letztendlich spielen die Instinkte und Erfahrungen des Chemikers eine entscheidende Rolle, um zu einem erfolgreichen Syntheseplan zu gelangen. Nachfolgend finden Sie einige relativ einfache Beispiele, von denen die meisten Einschränkungen hinsichtlich des Ausgangsmaterials aufweisen.
Übungen
Fragen
Q9.9.1
Beginnen Sie mit 3-Hexin und sagen Sie Synthesewege voraus, um Folgendes zu erreichen:
A – cis-3-Hexen
B – 3,4-Dibromhexan
C – 3-Hexanol
Q9.9.2
Ausgehend von Acetylen und beliebigen Alkylhalogeniden wird eine Synthese zur Herstellung von (a) Pentanal und (b) Hexan vorgeschlagen.
Lösungen
S9.9.1

S9.9.2
.png?revision=1)
Mitwirkende und Zuschreibungen
-
Dr. Dietmar Kennepohl FCIC (Professor für Chemie, Athabasca University)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, emeritierter Professor (Michigan State U.), Virtuelles Lehrbuch für Organische Chemie