12.2: Molverhältnisse
Molverhältnisse
Stöchiometrieprobleme können durch zwei Dinge charakterisiert werden: (1) die im Problem angegebenen Informationen und (2) die zu lösenden Informationen, die als unbekannt bezeichnet werden. Das Gegebene und das Unbekannte können beide Reaktanten sein, beide Produkte, oder einer kann ein Reaktant sein, während der andere ein Produkt ist. Die Mengen der Substanzen können in Mol ausgedrückt werden. In einer Laborsituation ist es jedoch üblich, die Menge eines Stoffes zu bestimmen, indem seine Masse in Gramm ermittelt wird. Die Menge einer gasförmigen Substanz kann durch ihr Volumen ausgedrückt werden. In diesem Konzept konzentrieren wir uns auf die Art des Problems, bei dem sowohl die angegebenen als auch die unbekannten Größen in Mol ausgedrückt werden.

Chemische Gleichungen drücken die Mengen an Reaktanten und Produkten in aus a Reaktanten und Produkte in einer Reaktion. Die Koeffizienten einer ausgeglichenen Gleichung können entweder die Anzahl der Moleküle oder die Anzahl der Mol jeder Substanz darstellen. Die Herstellung von Ammoniak \ (\ left (\ ce {NH_3} \ right) \) aus Stickstoff- und Wasserstoffgasen ist eine wichtige industrielle Reaktion, die nach dem deutschen Chemiker Fritz Haber als Haber-Verfahren bezeichnet wird.
\
Die ausgeglichene Gleichung kann auf verschiedene Arten analysiert werden, wie in der folgenden Abbildung gezeigt.
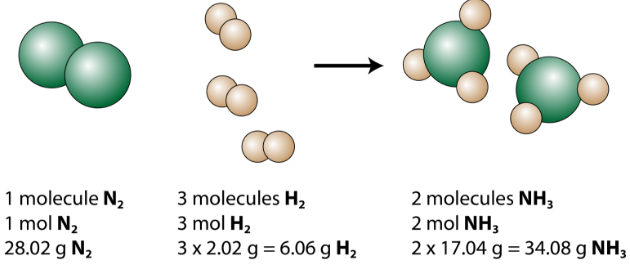
Wir sehen, dass 1 Stickstoffmolekül mit 3 Wasserstoffmolekülen unter Bildung von 2 Ammoniakmolekülen reagiert. Dies ist die kleinstmögliche relative Menge der Reaktanten und Produkte. Um größere relative Beträge zu berücksichtigen, kann jeder Koeffizient mit derselben Zahl multipliziert werden. Zum Beispiel würden 10 Stickstoffmoleküle mit 30 Wasserstoffmolekülen reagieren, um 20 Ammoniakmoleküle zu erzeugen.
Die nützlichste Menge zum Zählen von Partikeln ist das Mol. Wenn also jeder Koeffizient mit einem Mol multipliziert wird, sagt uns die ausgeglichene chemische Gleichung, dass 1 Mol Stickstoff mit 3 Mol Wasserstoff reagiert, um 2 Mol Ammoniak zu erzeugen. Dies ist die herkömmliche Methode zur Interpretation einer ausgeglichenen chemischen Gleichung.
\
Masse und Anzahl der Atome müssen bei jeder chemischen Reaktion erhalten bleiben. Die Anzahl der Moleküle muss nicht unbedingt erhalten bleiben.

Ein Molverhältnis ist ein Umrechnungsfaktor, der die Molmengen von zwei beliebigen Substanzen in einer chemischen Reaktion in Beziehung setzt. Die Zahlen in einem Umrechnungsfaktor stammen aus den Koeffizienten der ausgeglichenen chemischen Gleichung. Die folgenden sechs Molverhältnisse können für die obige Ammoniakbildungsreaktion geschrieben werden. Bei einem Molverhältnisproblem wird die gegebene Substanz, ausgedrückt in Mol, zuerst geschrieben. Der geeignete Umrechnungsfaktor wird gewählt, um von Mol der gegebenen Substanz in Mol des Unbekannten umzuwandeln